Содержание
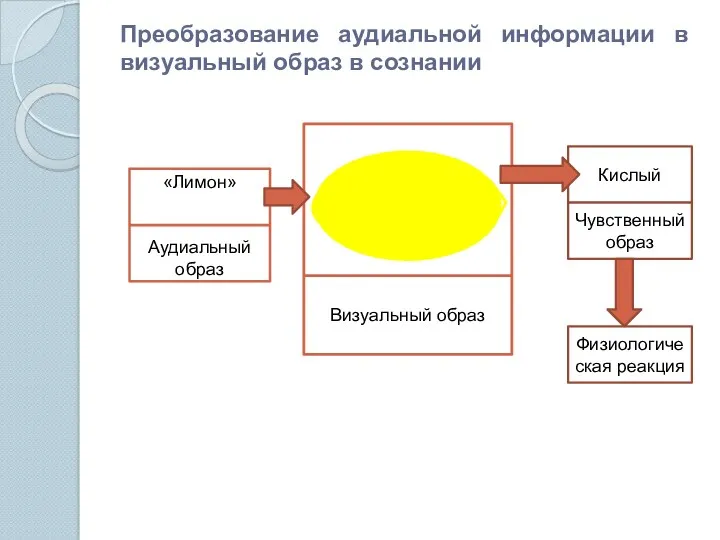
- 2. Преобразование аудиальной информации в визуальный образ в сознании «Лимон» Аудиальный образ Визуальный образ Кислый Чувственный образ
- 3. Стратегия «выдвижения гипотез» в решении задач на «избыток-недостаток» Согласно концепции модернизации образования, сегодня «общеобразовательная школа должна
- 4. 1-й способ: через количество вещества 1) Рассчитать количество вещества по формулам: 2) Соотнести полученные количества веществ
- 5. 4) Определить количество продукта реакции по веществу, взятому в недостатке т.е. по MgCl2: 0,5 моль 0,5
- 6. 2-й способ: метод пропорции 1) Из наличия в условии задачи масс двух реагирующих веществ сделать вывод
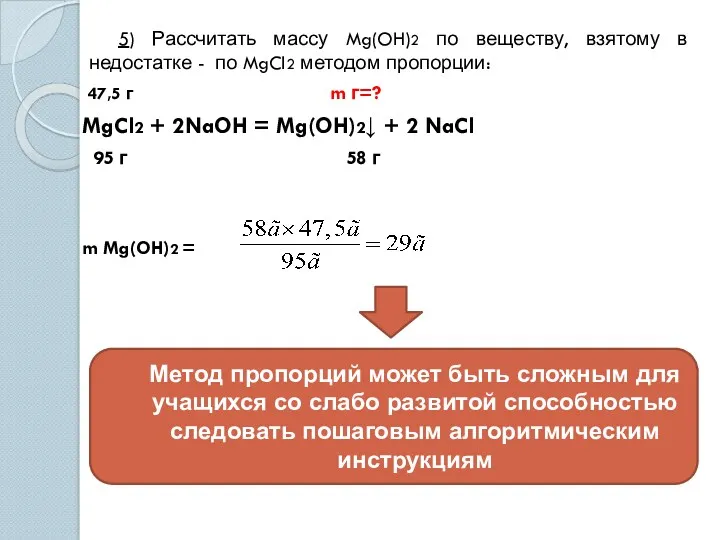
- 7. 5) Рассчитать массу Mg(OH)2 по веществу, взятому в недостатке - по MgCl2 методом пропорции: 47,5 г
- 8. 3-й способ является следствием закона постоянства состава веществ 1) Записать уравнение реакции. Проставить массы, данные в
- 9. 4-й способ: стратегия «ВЫДВИЖЕНИЯ ГИПОТЕЗ» 1) Необходимо посмотреть задачу с позиции конечного результата. Выдвинуть две гипотезы:
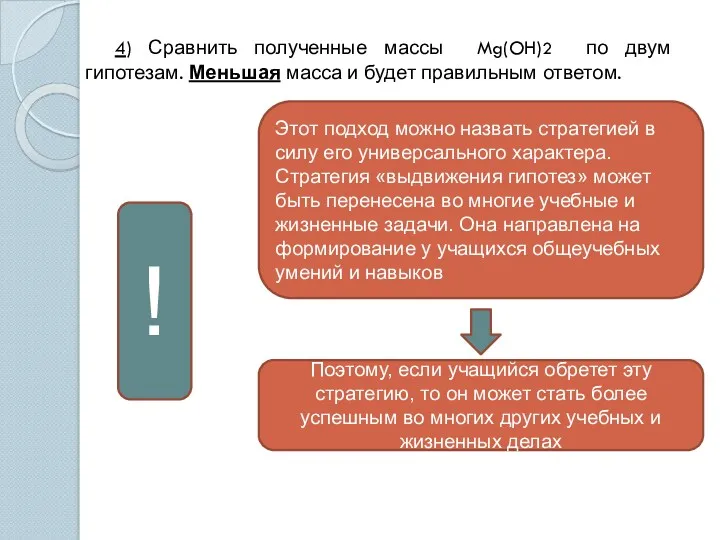
- 10. 4) Сравнить полученные массы Mg(OH)2 по двум гипотезам. Меньшая масса и будет правильным ответом. Этот подход
- 11. Примеры решения задач методом заполнения таблиц Задача №1. Смешали 100г 10%-го р-ра NaOH и 100г 10%-го
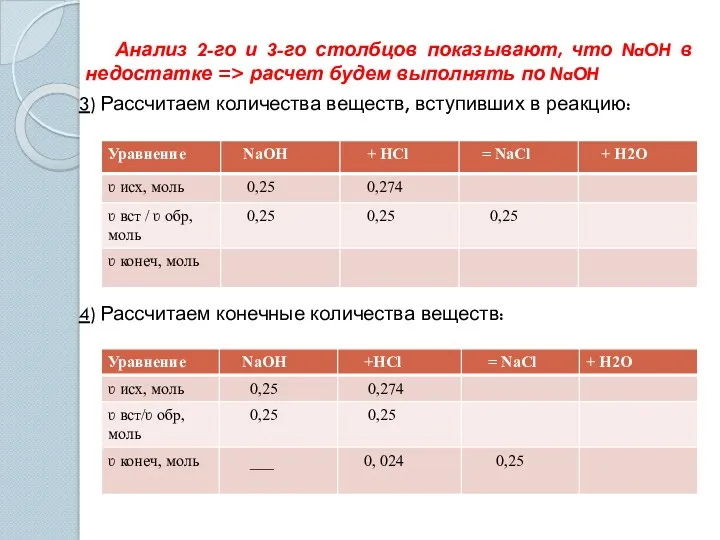
- 12. Анализ 2-го и 3-го столбцов показывают, что NaOH в недостатке => расчет будем выполнять по NaOH
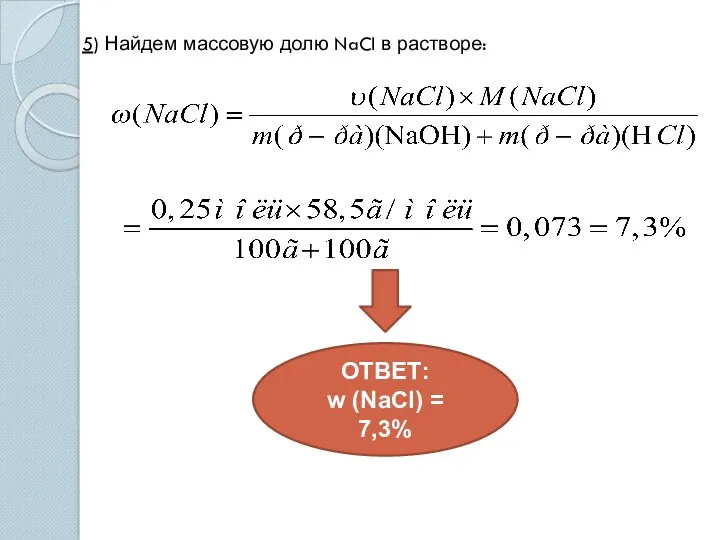
- 13. 5) Найдем массовую долю NaCl в растворе: ОТВЕТ: w (NaCl) = 7,3%
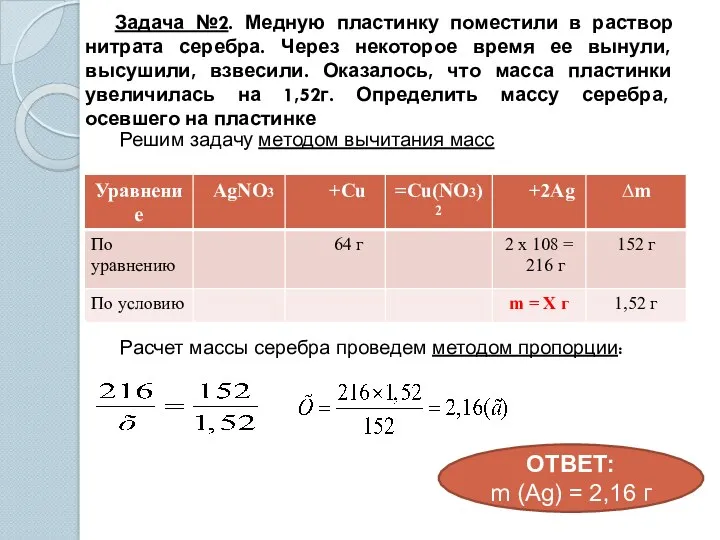
- 14. Задача №2. Медную пластинку поместили в раствор нитрата серебра. Через некоторое время ее вынули, высушили, взвесили.
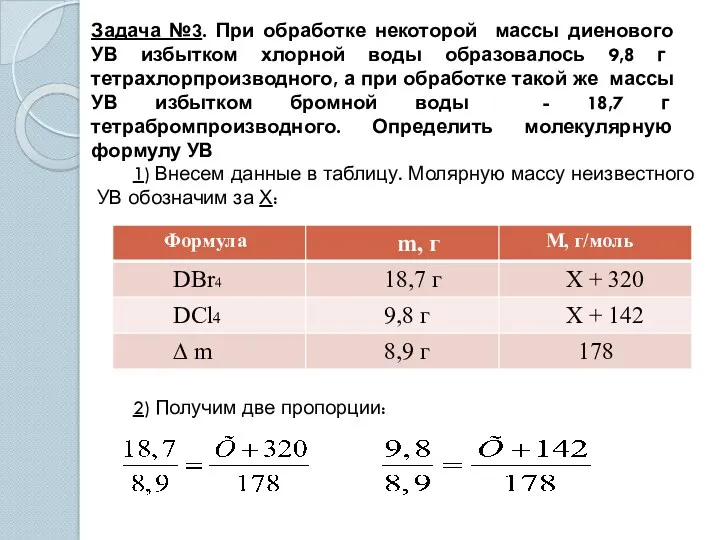
- 15. Задача №3. При обработке некоторой массы диенового УВ избытком хлорной воды образовалось 9,8 г тетрахлорпроизводного, а
- 16. При решении любой пропорции Х = 54 3) Исходя из общей формулы алкадиена CnH2n-2, составим уравнение:
- 17. Задача №4. Масса смеси оксидов углерода равна 44 г, объем смеси 28 л(н.у.). Найти соотношение между
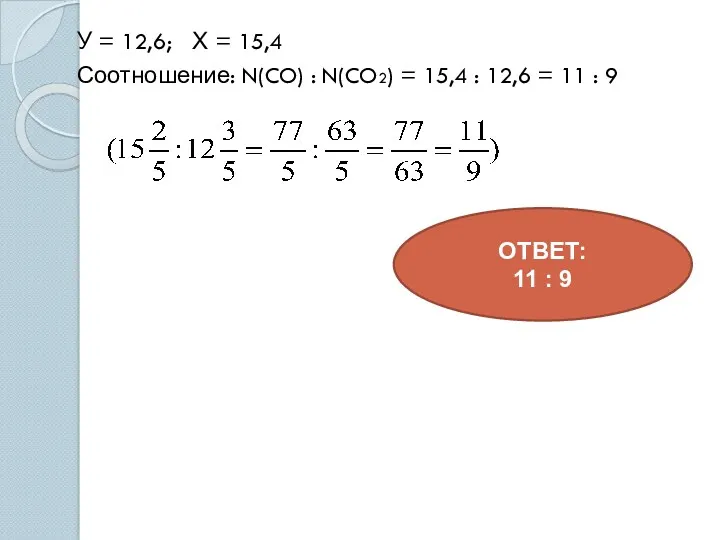
- 18. У = 12,6; Х = 15,4 Соотношение: N(CO) : N(CO2) = 15,4 : 12,6 = 11
- 19. Спасибо за внимание!
- 21. Скачать презентацию










 Портфолио учителя технологии
Портфолио учителя технологии Тукайга килэ халык...
Тукайга килэ халык... Логические схемы. Определение, построение, преобразование
Логические схемы. Определение, построение, преобразование Вводный учебный курс для новых дилеров Audi. Двигатели
Вводный учебный курс для новых дилеров Audi. Двигатели Leben und Schaffen von Johann Wolfgang von Goethe
Leben und Schaffen von Johann Wolfgang von Goethe Задачи, содержание и формы организации работы на уроках ППО
Задачи, содержание и формы организации работы на уроках ППО УФК по Республике Крым. Подключение к системе Электронный бюджет
УФК по Республике Крым. Подключение к системе Электронный бюджет Как стать менеджером
Как стать менеджером Obliczenia w Matlabie. Operatory, instrukcje sterujące, operacje bitowe
Obliczenia w Matlabie. Operatory, instrukcje sterujące, operacje bitowe Презентация по теме География религий
Презентация по теме География религий Гидропрессы. Приводы гидравлических прессов
Гидропрессы. Приводы гидравлических прессов Народные художественные промыслы России. Хохлома
Народные художественные промыслы России. Хохлома Сердце отдаю детям творческий отчет-презентация работы кружка Умелые руки.
Сердце отдаю детям творческий отчет-презентация работы кружка Умелые руки. Алексей Михайлович Романов 1645 - 1676
Алексей Михайлович Романов 1645 - 1676 БАД к пище желе с коллагеном Тяньши
БАД к пище желе с коллагеном Тяньши Как выбрать линолеум? Советы от Парней из Камня
Как выбрать линолеум? Советы от Парней из Камня Макет выпускной квалификационной работы
Макет выпускной квалификационной работы Загальна характеристика електронної комерції в міжнародному торговому праві
Загальна характеристика електронної комерції в міжнародному торговому праві Выставление оценок в электронный журнал
Выставление оценок в электронный журнал Материалы, применяемые в машиностроении
Материалы, применяемые в машиностроении Монтаж квартальных сетей и вводов
Монтаж квартальных сетей и вводов Школьная газета
Школьная газета Продвижение в Интернете. Создание web-сайта
Продвижение в Интернете. Создание web-сайта Личные местоимения
Личные местоимения Пожарный – герой!
Пожарный – герой! Консультация для воспитателей Самообразование воспитателей детского сада по ФГОС
Консультация для воспитателей Самообразование воспитателей детского сада по ФГОС Топливо и маслозаправочные колонки. Тема №6
Топливо и маслозаправочные колонки. Тема №6 Урок Население Африки
Урок Население Африки