Содержание
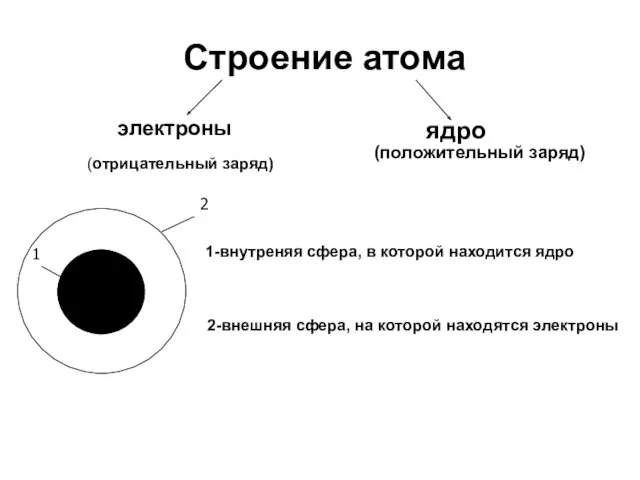
- 5. Строение атома электроны ядро 1-внутреняя сфера, в которой находится ядро 2-внешняя сфера, на которой находятся электроны
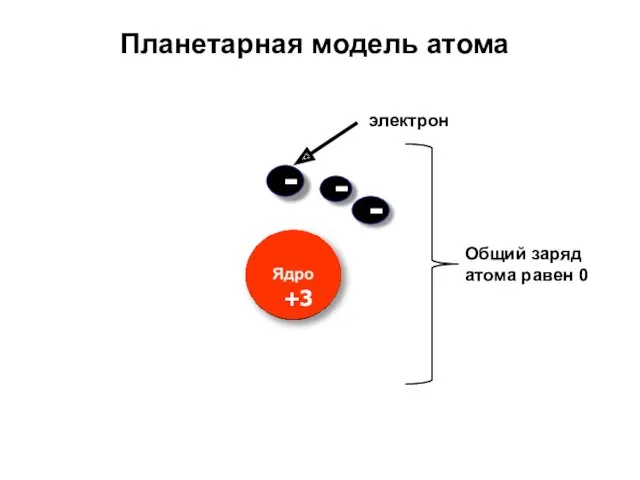
- 6. Планетарная модель атома электрон + Общий заряд атома равен 0 - 3 - -
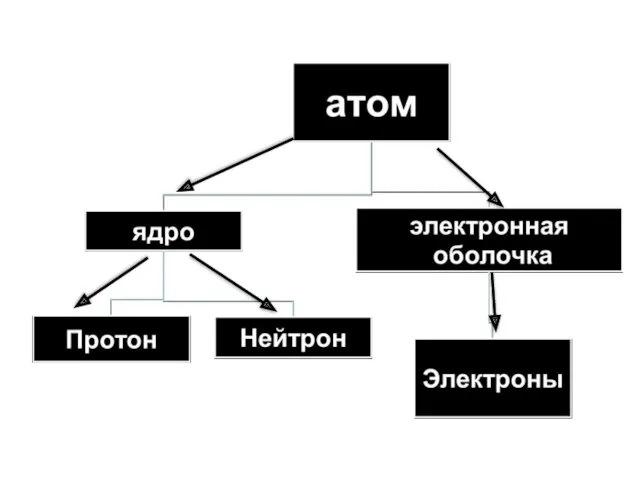
- 8. Современная модель атома Атом – электронейтральная частица Ядро атома – положительно заряженное Электроны – отрицательно заряженные
- 9. Число протонов = заряду атомного ядра = числу электронов = = порядковому номеру элемента Mg 12
- 10. Состав ядра атома Протоны. Масса = 1, заряд = +1 Нейтроны. Масса = 1, заряд =
- 11. Масса атома – это масса его ядра. Число протонов + число нейтронов = массовое число (А)
- 12. Химический элемент – это вид атомов с одинаковым зарядом ядра (с одинаковым числом протонов в ядре)
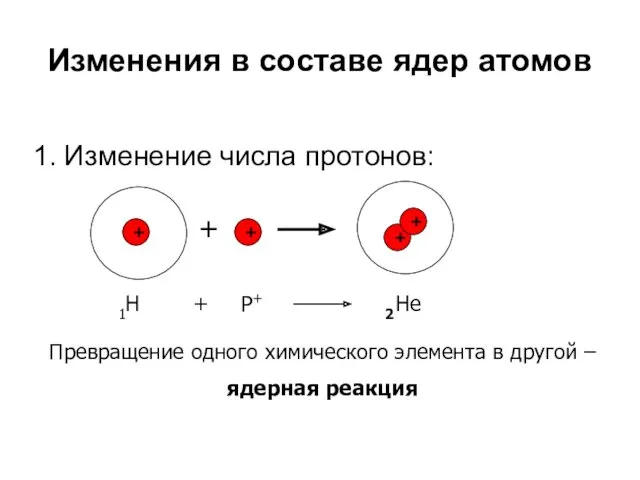
- 13. Изменения в составе ядер атомов 1. Изменение числа протонов: + + + + + 1Н Р+
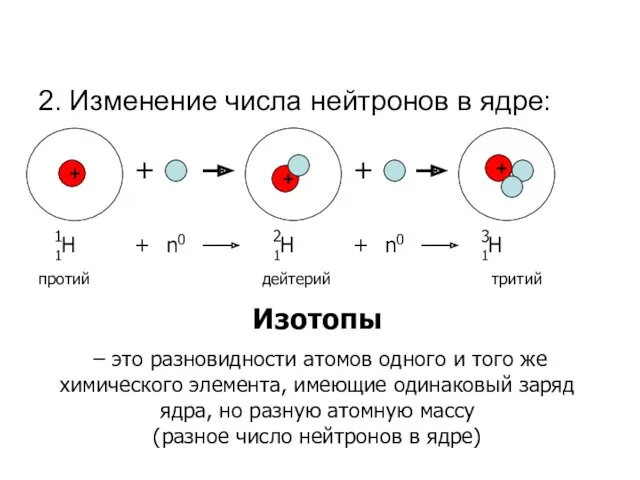
- 14. 2. Изменение числа нейтронов в ядре: + 1Н + + + + 1 + n0 1Н
- 15. Электронные оболочки Строение электронных оболочек атомов играет важную роль в химии, так как именно электроны (особенно
- 16. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень. На первой оболочке располагается
- 17. Электрон движется не по орбите, а по орбитали, и не имеет траектории. Пространство вокруг ядра, где
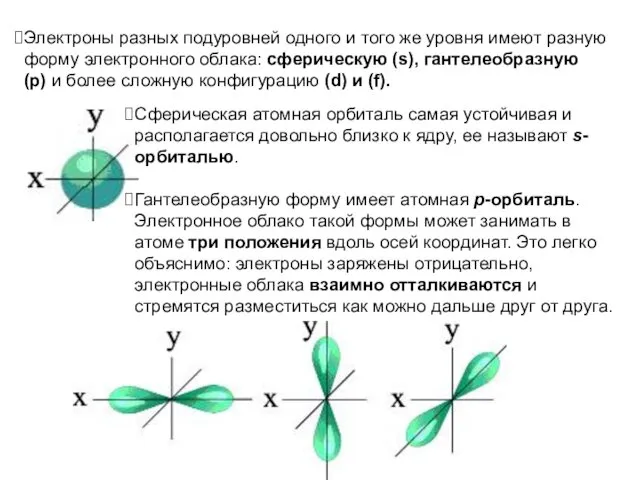
- 18. Электроны разных подуровней одного и того же уровня имеют разную форму электронного облака: сферическую (s), гантелеобразную
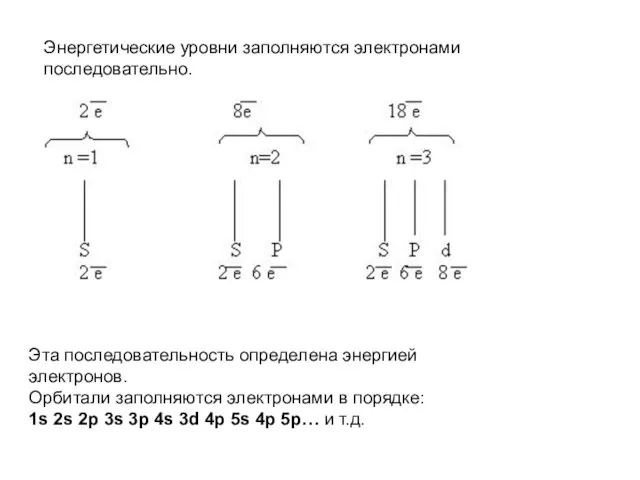
- 19. Энергетические уровни заполняются электронами последовательно. Эта последовательность определена энергией электронов. Орбитали заполняются электронами в порядке: 1s
- 20. Алгоритм составления электронных формул атомов Определяем общее число электронов на оболочке по порядковому номеру элемента. Определяем
- 21. Примеры. 1. Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон
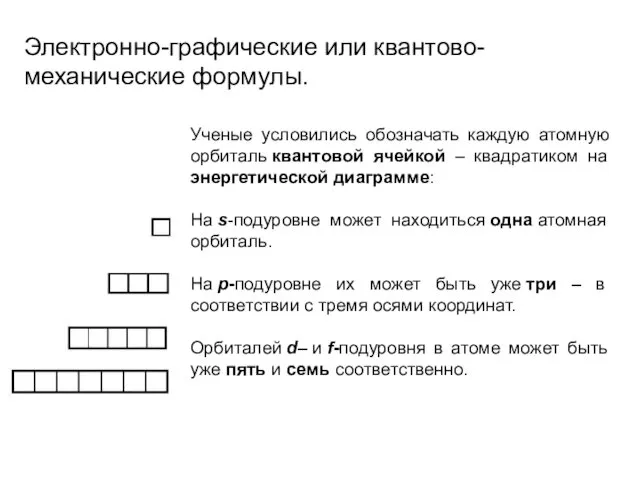
- 22. Электронно-графические или квантово-механические формулы. Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой – квадратиком на энергетической
- 23. Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном
- 24. Принципы заполнения электронных орбиталей атомов: Принцип Паули: на каждой орбитали может находиться не более двух электронов
- 26. Скачать презентацию














 Вывод формул для расчета современной (текущей) стоимости обычной ренты (постнумерандо). (Тема 5.4)
Вывод формул для расчета современной (текущей) стоимости обычной ренты (постнумерандо). (Тема 5.4) Термическая обработка сварных изделий
Термическая обработка сварных изделий Презентация Мы и наше здоровье
Презентация Мы и наше здоровье Россия – многонациональная культура
Россия – многонациональная культура Возбудитель сибирской язвы
Возбудитель сибирской язвы Происхождение банков и развитие банковского дела
Происхождение банков и развитие банковского дела Презентация диплом НАК лемачко версия2
Презентация диплом НАК лемачко версия2 Порушення прав у казці
Порушення прав у казці Презентация Герои войны - кто они?
Презентация Герои войны - кто они? Презентация рабочей программы Валеологическое воспитание дошкольников
Презентация рабочей программы Валеологическое воспитание дошкольников Трудовое право
Трудовое право Здоровьесберегающие технологии для детей с ОНР
Здоровьесберегающие технологии для детей с ОНР Архитектурные шрифты. Правила построения
Архитектурные шрифты. Правила построения Архитектура микропроцессора
Архитектура микропроцессора Задание на дизайн-проект квартиры
Задание на дизайн-проект квартиры Периферийные устройства. Мониторы
Периферийные устройства. Мониторы Обязательное страхование автогражданской ответственности (ОСАГО)
Обязательное страхование автогражданской ответственности (ОСАГО) Экологический проект 2016/2017 года. Начальная школа
Экологический проект 2016/2017 года. Начальная школа Основные положения молекулярно-кинетической теории. (10 класс)
Основные положения молекулярно-кинетической теории. (10 класс) Отчет по теме самообразования: Развитие творческих способностей воспитателя через ознакомление детей с русским народным творчеством
Отчет по теме самообразования: Развитие творческих способностей воспитателя через ознакомление детей с русским народным творчеством Описание технологического процесса приготовления палтуса в зеленом соусе, пирожков печеных с капустным фаршем
Описание технологического процесса приготовления палтуса в зеленом соусе, пирожков печеных с капустным фаршем Ветераны школы №1
Ветераны школы №1 Методическая разработка урока географии в 7 классе Географическое положение Африки. История открытия и исследования материка
Методическая разработка урока географии в 7 классе Географическое положение Африки. История открытия и исследования материка El participio pasado. El pretérito perfecto de indicativo
El participio pasado. El pretérito perfecto de indicativo Конспект урока географии в 6 классе Землетрясения: причины и последствия
Конспект урока географии в 6 классе Землетрясения: причины и последствия Интеллектуальный лабиринт Увлекательный мир химии
Интеллектуальный лабиринт Увлекательный мир химии Опыт подготовки к ЕГЭ на примере заданий по истории Великой Отечественной войны
Опыт подготовки к ЕГЭ на примере заданий по истории Великой Отечественной войны Важные навыки в работе. Предметы и профессии
Важные навыки в работе. Предметы и профессии