Слайд 2

Слайд 3

Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании
ковалентной связи для достижения более эффективного перекрывания орбиталей.
Слайд 4

Различные орбитали, несильно отличающиеся энергиями, образуют соответствующее число гибридных орбиталей. Число
гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации. Гибридные орбитали одинаковы по форме электронного облака и по энергии.
Слайд 5

В гибридизации участвуют не только связывающие электроны, но и неподеленные электронные
пары.
Слайд 6

По сравнению с атомными орбиталями гибридные более вытянуты в направлении образования
химических связей и поэтому обуславливают лучшее перекрывание электронных облаков.
Слайд 7

Гибридная орбиталь больше вытянута по одну сторону ядра,
чем по другую.
Слайд 8

Слайд 9
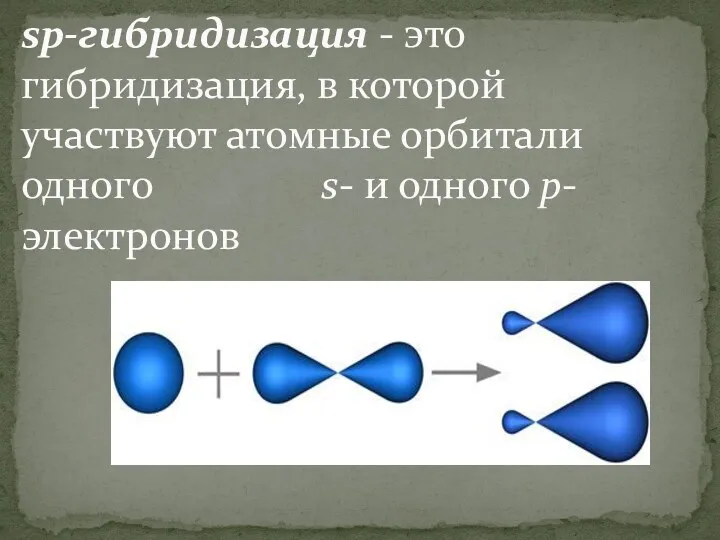
sp-гибридизация - это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов
Слайд 10

В процессе гибридизации образуются 2 гибридные орбитали, которые ориентируются друг к другу
под углом 180°
Слайд 11

Представление о sp-гибридизации орбиталей можно применить для объяснения линейной формы молекулы BeH2,
в которой атом бериллия образован гибридными
sp-орбиталями.
Слайд 12

Образование молекулы фторида бериллия .
Каждый атом фтора, входящий в состав этой
молекулы, обладает одним неспаренным электроном,
который и участвует в образовании ковалентной связи.
Слайд 13
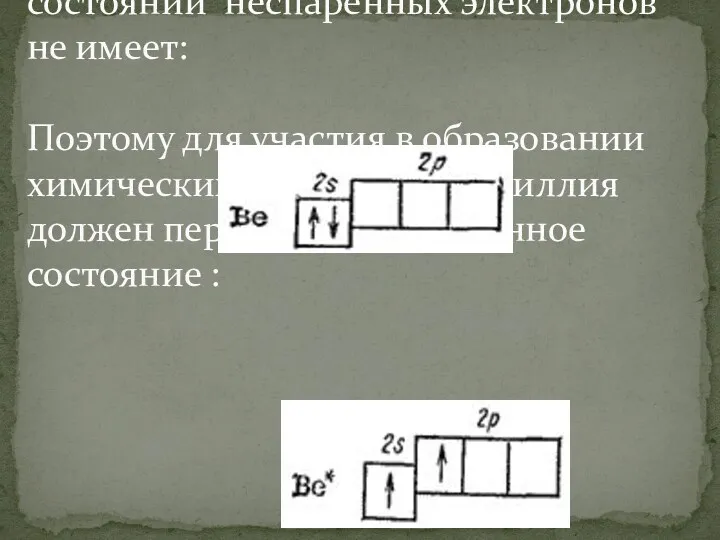
Атом бериллия в невозбужденном состоянии неспаренных электронов не имеет:
Поэтому для участия в
образовании химических связей атом бериллия должен перейти в возбужденное состояние :
Слайд 14

при затрате некоторой энергии вместо исходных s- и р-орбиталей атома бериллия
могут образоваться две равноценные гибридные орбитали
(sp-орбитали).
Слайд 15

Примеры химических соединений, для которых характерна
sp-гибридизация: BeCl2, BeH2,CO, CO2, HCN, карбин, ацетиленовые углеводороды
(алкины).
Слайд 16

sp2-гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов
Слайд 17

В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под
углом 120° друг к другу
Слайд 18
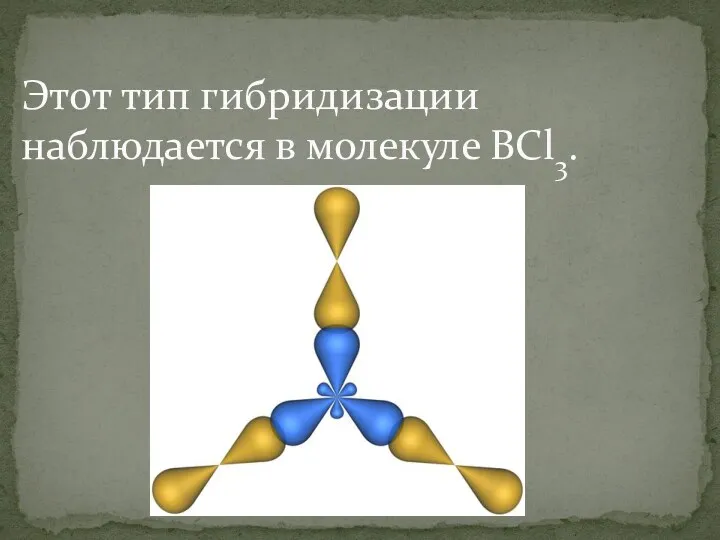
Этот тип гибридизации наблюдается в молекуле BCl3.
Слайд 19
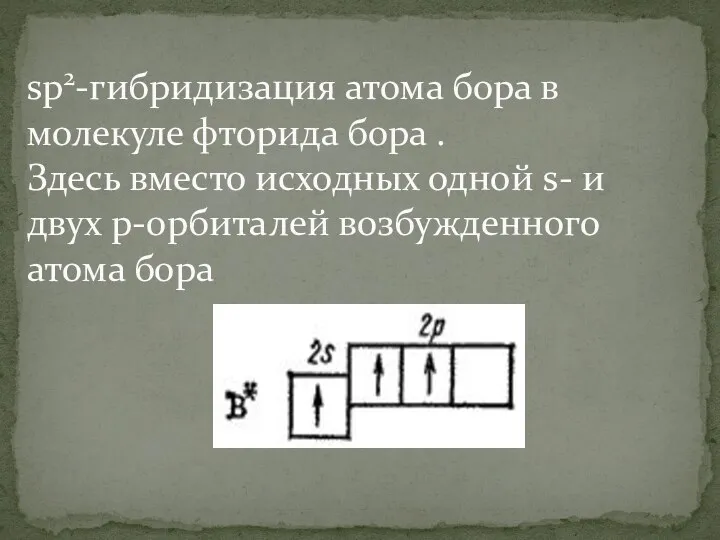
sp2-гибридизация атома бора в молекуле фторида бора .
Здесь вместо исходных одной
s- и двух р-орбиталей возбужденного атома бора
Слайд 20

образуются три равноценные
sp2-орбитали. Поэтому молекула построена в форме правильного треугольника, в центре
которого расположен атом бора, а в вершинах—атомы фтора.
Слайд 21

Примеры соединений, в которых наблюдается sp2-гибридизация: SO3, BCl3, BF3, AlCl3, CO32-, NO3-,
графит, этиленовые углеводороды (алкены), карбоновые кислоты и ароматические углеводороды (арены).
Слайд 22

sp3-гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех
p-электронов
Слайд 23

Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28'
Слайд 24

не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа
атомов в молекуле.
Примером тому служат молекул воды и аммиакаNH3.
Слайд 25

Валентность атома азота – III, его пять электронов внешнего уровня занимают
четыре орбитали, значит, тип гибридизации – sp3, но только три орбитали принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в пирамиду. Поэтому у молекулы аммиака форма молекулы пирамидальная, угол связи искажается до 107°30′.
Слайд 26

кислород в молекуле воды находится в sp3 гибридном состоянии, а форма молекулы -
угловая, угол связи составляет 104°27′.

























 Споруди та пристрої сигналізації, зв'язку і обчислювальної техніки. Сигнали. (Розділ 6)
Споруди та пристрої сигналізації, зв'язку і обчислювальної техніки. Сигнали. (Розділ 6) Pavel_Blyume_prezentatsia
Pavel_Blyume_prezentatsia Противофазное включение двигателей СН в момент восстановления питания. ЭЧСЭСП, часть 4, лекции 35-45
Противофазное включение двигателей СН в момент восстановления питания. ЭЧСЭСП, часть 4, лекции 35-45 Техническое обследование жилых зданий. (Тема 1)
Техническое обследование жилых зданий. (Тема 1) Инфекционные болезни
Инфекционные болезни Связьтранснефть I квартал 2021, свод замечаний СКК
Связьтранснефть I квартал 2021, свод замечаний СКК Master class de português
Master class de português Водные обитатели. Рыбы
Водные обитатели. Рыбы Посвящение в члены Отряда юных пожарных
Посвящение в члены Отряда юных пожарных Петербургские повести Н.В. Гоголя. Образ маленького человека в литературе
Петербургские повести Н.В. Гоголя. Образ маленького человека в литературе Основні поняття хімічної термодинаміки
Основні поняття хімічної термодинаміки Презентация Программа Система диагностики и коррекции психического развития детей дошкольного возраста
Презентация Программа Система диагностики и коррекции психического развития детей дошкольного возраста Системные платы
Системные платы Культурная жизнь Кубани в период оттепели.
Культурная жизнь Кубани в период оттепели. Внешняя политика в XVII веке
Внешняя политика в XVII веке Презентация Река и ее части
Презентация Река и ее части Домашние животные
Домашние животные Биполярные транзисторы
Биполярные транзисторы Этапы процесса транскрипции в генетике. (Лекция 16)
Этапы процесса транскрипции в генетике. (Лекция 16) Арифметические операции в системах счисления
Арифметические операции в системах счисления Жердің ғаламшар ретіндегі жалпы сипаттамасы
Жердің ғаламшар ретіндегі жалпы сипаттамасы Расписание автобусов с 30 04 2020
Расписание автобусов с 30 04 2020 Точение. Правильный выбор геометрии
Точение. Правильный выбор геометрии Ливонская война
Ливонская война Студенческая олимпиада: Я-профессионал
Студенческая олимпиада: Я-профессионал Улучшение окружающей среды.
Улучшение окружающей среды. Создания в классе развивающей среды как условия повышения образовательного потенциала обучающихся
Создания в классе развивающей среды как условия повышения образовательного потенциала обучающихся Профилактика табакокурения у подростков
Профилактика табакокурения у подростков