Слайд 2

Что такое гидролиз?
Гидролиз – реакция обменного разложения веществ водой.
Гидролиз – это
процесс взаимодействия ионов соли с водой, приводящий к образованию слабого электролита.
Слайд 3
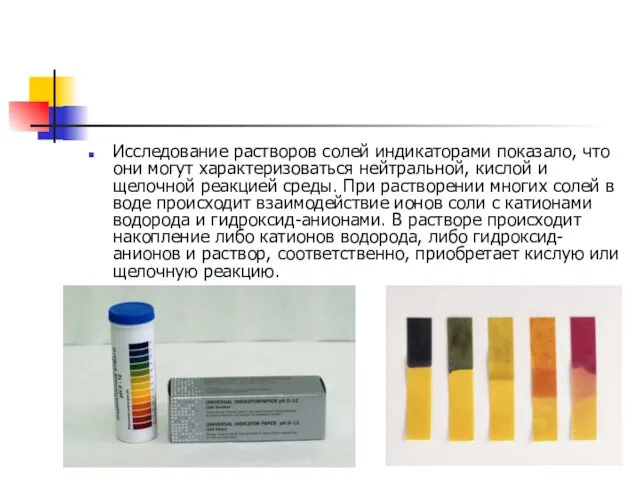
Исследование растворов солей индикаторами показало, что они могут характеризоваться нейтральной, кислой
и щелочной реакцией среды. При растворении многих солей в воде происходит взаимодействие ионов соли с катионами водорода и гидроксид-анионами. В растворе происходит накопление либо катионов водорода, либо гидроксид-анионов и раствор, соответственно, приобретает кислую или щелочную реакцию.
Слайд 4

Слайд 5

Рассматривая соли, как продукт взаимодействия кислоты с основанием, выделяют четыре типа
гидролиза в зависимости от силы исходных кислоты и основания.
Слайд 6

1. гидролиз соли, образованной сильным основанием и слабой кислотой
щелочная среда
протекает в
направлении накопления ионов гидроксо-группы (щелочная среда). Фенолфталеин малиновый.
Слайд 7
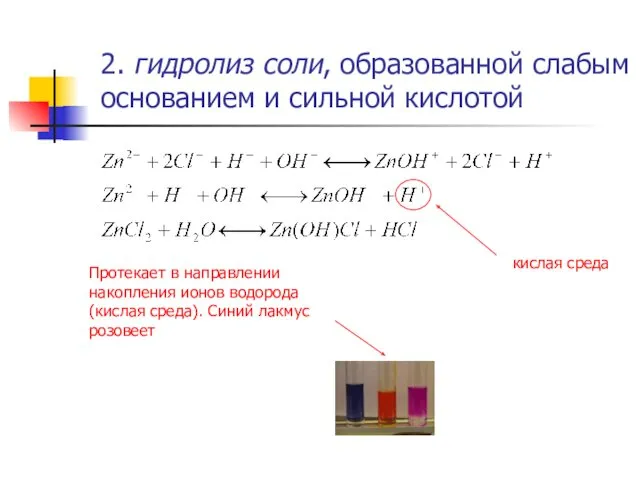
2. гидролиз соли, образованной слабым основанием и сильной кислотой
кислая среда
Протекает в
направлении накопления ионов водорода (кислая среда). Синий лакмус розовеет
Слайд 8

3. гидролиз соли, образованной сильным основанием и сильной кислотой
нейтральная среда
Индикатор
сохраняет свой цвет
Слайд 9

4. гидролиз соли, образованной слабым основанием и слабой кислотой
гидролиз такой соли
не имеет смысла. Гидролиз идет и по катиону и по аниону. Реакция идет до конца с образованием соответствующих кислоты и основания. Реакция среды растворов таких солей зависит от относительной силы образующихся слабых кислот и оснований и может быть либо нейтральной, либо слабощелочной, либо слабокислой
Слайд 10

Слайд 11
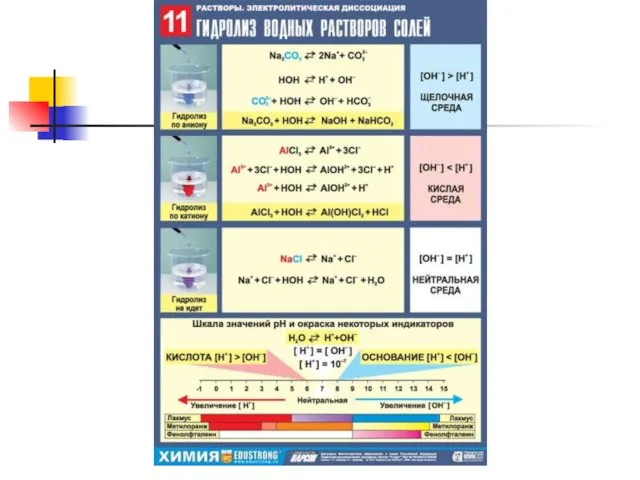
Слайд 12

Слайд 13

Выводы:
Процесс гидролиза обратимый;
В реакции гидролиза участвуют одна молекула воды с одной
молекулой соли;
AgNO3 гидролизу не подвергается.
Слайд 14













 Fiberglass rod
Fiberglass rod Мастер класс по математике 3
Мастер класс по математике 3 Современные наглядные пособия, моделей, направленные на развитие у детей логико-математического мышления
Современные наглядные пособия, моделей, направленные на развитие у детей логико-математического мышления 9 класс. Электив. Уравнения.
9 класс. Электив. Уравнения. EMS mulfunction
EMS mulfunction История аудита. Цели и структура Международных стандартов аудита
История аудита. Цели и структура Международных стандартов аудита Приобщение детей к национально-культурным традициям с помощью коллажей и мнемотаблиц
Приобщение детей к национально-культурным традициям с помощью коллажей и мнемотаблиц Презентация Мой адрес в этом мире
Презентация Мой адрес в этом мире Календари религий мира
Календари религий мира Расчет ж/б конструкций по предельным состояниям
Расчет ж/б конструкций по предельным состояниям Экономия электроэнергии для стиральной машины
Экономия электроэнергии для стиральной машины Движения земной коры
Движения земной коры Азот, его строение и свойства
Азот, его строение и свойства Значение транспортного законодательства для страхования грузов и транспортных средств
Значение транспортного законодательства для страхования грузов и транспортных средств Строительство высоковольтных линий электропередачи и подстанций напряжением 0,4-10-110750 кВ
Строительство высоковольтных линий электропередачи и подстанций напряжением 0,4-10-110750 кВ Решение задач по готовым чертежам. Теорема Пифагора
Решение задач по готовым чертежам. Теорема Пифагора Intermediate 08. Located
Intermediate 08. Located Симметрия. Осевая и центральная симметрия
Симметрия. Осевая и центральная симметрия Интернет-ресурсы в образовании
Интернет-ресурсы в образовании Астероїди. Етимологія астероїду
Астероїди. Етимологія астероїду Студия красоты с высоким уровнем сервиса и качества
Студия красоты с высоким уровнем сервиса и качества Аналіз діяльності транснаціональної корпорації Toyota Motor Corporation
Аналіз діяльності транснаціональної корпорації Toyota Motor Corporation Любовная лирика М.Ю. Лермонтова
Любовная лирика М.Ю. Лермонтова Искусственный отбор, основы селекции
Искусственный отбор, основы селекции Презентация к уроку Умножение чисел, полученных при измерении, на 10, 100, 1000
Презентация к уроку Умножение чисел, полученных при измерении, на 10, 100, 1000 Презентация к занятию: История казачьей вышивки
Презентация к занятию: История казачьей вышивки Автоматические системы управления курсом судна
Автоматические системы управления курсом судна Учебно-тренировочный сбор Твоё здоровье
Учебно-тренировочный сбор Твоё здоровье