Слайд 2

Слайд 3

Цель урока:
Вскрыть причину образования химической связи
Актуализировать знания о видах химической связи
Показать
относительный характер ее классификации.
Слайд 4

Причиной образования химической связи является стремление системы к минимуму энергии:
при её образовании, как правило, энергия выделяется, образующаяся система обладает меньшей энергией, чем изолированные атомы.
Происходит уменьшение энергии на величину энергии связи(Есв.).
Энергия связи (Есв.)- энергия, необходимая для разрушения этой связи.
Слайд 5

Химическая связь- взаимодействие между атомами, приводящее к образованию устойчивой системы- молекулы,
иона, кристалла.
Слайд 6

Ковалентная связь- связь между атомами, возникающая за счёт образования общих электронных
пар.
Способы образования общей электронной пары:
- двумя неспаренными электронами-обменный механизм:
А . + .В = А : В или А-В (1:1)
-электронной парой и свободной орбиталью- донорно- акцепторный механизм:
А: + В= А : В или А-В (2:0)
Слайд 7

Полярность ковалентной связи
Она определяется разницей значений э.о связанных атомов.
Слайд 8
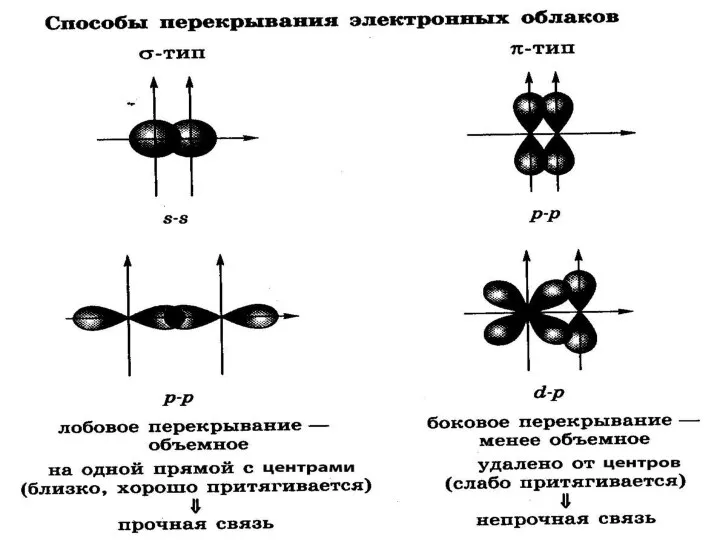
Слайд 9

Слайд 10

Ионная связь- электростатическое притяжение между ионами.
Ионных соединений немного:
элементы +
элементы
I и IIгр. гл. подгр. VI и VII гр. гл. подгр.
Если значение э.о >= 2,то связь считают ионной.Если же значение э.о <2,то ковалентной полярной.
Чёткой границы между ионной и ковалентной полярной связью НЕТ.
Слайд 11
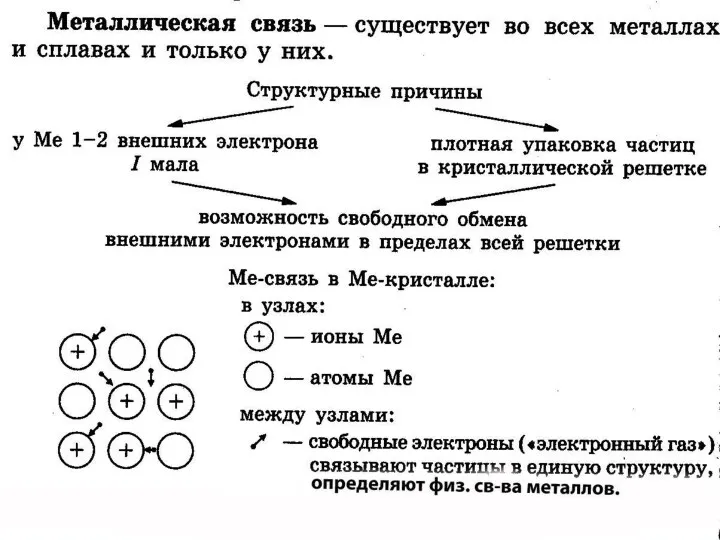
Слайд 12

Водородная связь- электростатической притяжение между положительно поляризованными атомами водорода одной молекулы
и отрицательно поляризованными атомами( F,O,N, реже S,Cl) другой молекулы.
Слайд 13

Водородная связь бывает:
Межмолекулярная
Внутримолекулярная
Слайд 14
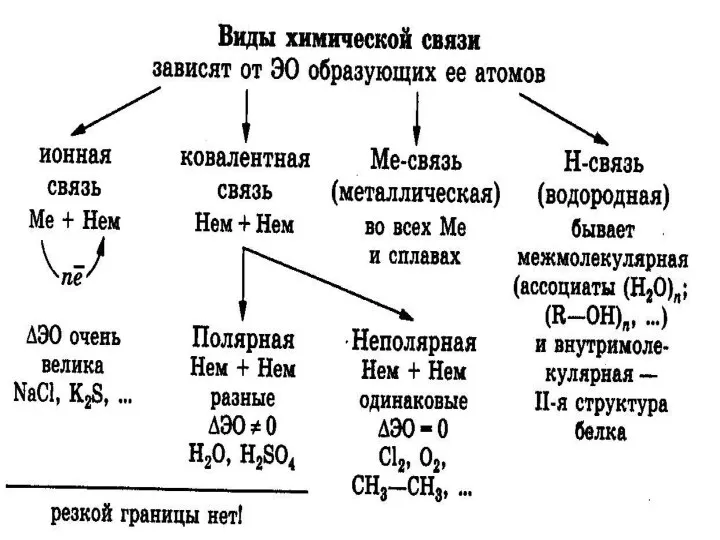













 Репродуктивное здоровье населения и национальная безопасность России
Репродуктивное здоровье населения и национальная безопасность России Мультимедийная игра
Мультимедийная игра Как и где зимуют птицы (1 класс)
Как и где зимуют птицы (1 класс) Разработка программы парсинга psd шаблона в website
Разработка программы парсинга psd шаблона в website Введение в гнатологию
Введение в гнатологию Презентация Добрые дела на все времена
Презентация Добрые дела на все времена Презентация Автоматизация звука Л в слогах
Презентация Автоматизация звука Л в слогах Презентация к уроку основания
Презентация к уроку основания Готика
Готика Передача двумя руками снизу.
Передача двумя руками снизу. Татарску 100 лет.
Татарску 100 лет. Однофазная цепь переменного тока
Однофазная цепь переменного тока Липиды (5 B)
Липиды (5 B) Основы наноэлектроники и нанотехнологий. Наноэлектроника. Фактор нано-. (Лекция 1)
Основы наноэлектроники и нанотехнологий. Наноэлектроника. Фактор нано-. (Лекция 1) Артериальная гипертензия (АГ). Гипертоническая болезнь (ГБ)
Артериальная гипертензия (АГ). Гипертоническая болезнь (ГБ) Создание мультимедийной презентации
Создание мультимедийной презентации Петрофизика. Пористость. Виды пористости
Петрофизика. Пористость. Виды пористости Афинское государство в архаический период VIII-VI веков до новой эры
Афинское государство в архаический период VIII-VI веков до новой эры класс Риторика Презентация Необычные тексты
класс Риторика Презентация Необычные тексты Создание ситуации успеха учащихся в изобразительной деятельности через использование нетрадиционных техник рисования
Создание ситуации успеха учащихся в изобразительной деятельности через использование нетрадиционных техник рисования Технология личностно - ориентированного развивающего обучения: методы и приемы
Технология личностно - ориентированного развивающего обучения: методы и приемы презентация на тему: Развитие профессиональных компетенций педагога дошкольной образовательной организации
презентация на тему: Развитие профессиональных компетенций педагога дошкольной образовательной организации ТС сигналдарын қабылдау және кодадан шығару кезіндегі орталық пост аппаратураларының жұмысы
ТС сигналдарын қабылдау және кодадан шығару кезіндегі орталық пост аппаратураларының жұмысы Методика обучения пространственно-объемным видам искусства
Методика обучения пространственно-объемным видам искусства Консульство и образование наполеоновской империи
Консульство и образование наполеоновской империи презентация к занятию: Давайте жить дружно!
презентация к занятию: Давайте жить дружно! Лепка. Из истории лепки. Рисунок на пластилине
Лепка. Из истории лепки. Рисунок на пластилине Презентация 9.Натурные зарисовки натюрморта с введением декоративности
Презентация 9.Натурные зарисовки натюрморта с введением декоративности