Содержание
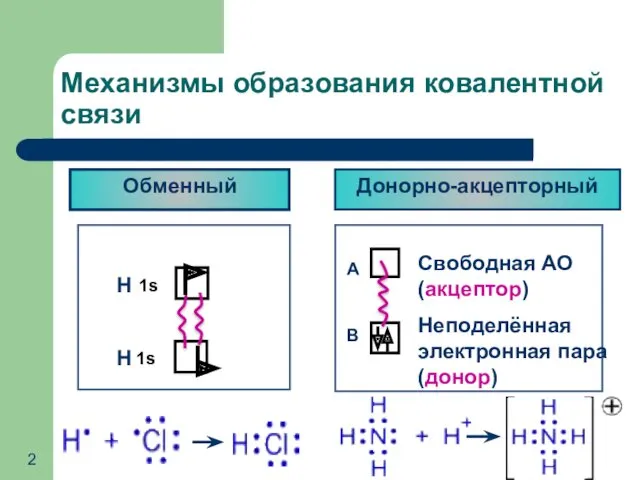
- 2. Механизмы образования ковалентной связи Обменный Донорно-акцепторный
- 3. Пример I: образование ковалентной связи в молекуле N2 NΞN Есвязи NΞN = 941,4 кДж/моль Есвязи N―N
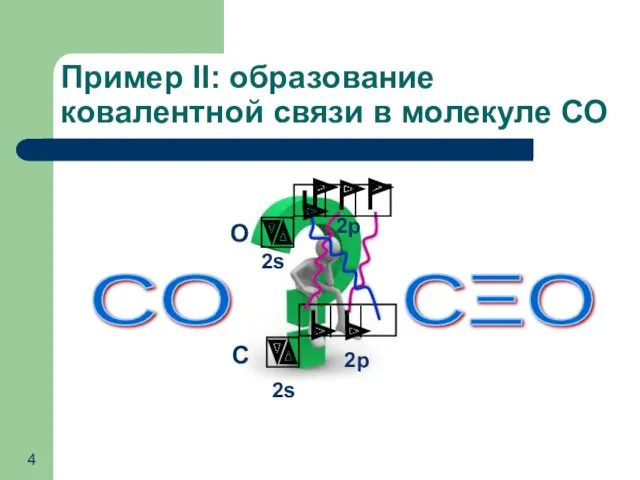
- 4. Пример II: образование ковалентной связи в молекуле СО CO CΞO
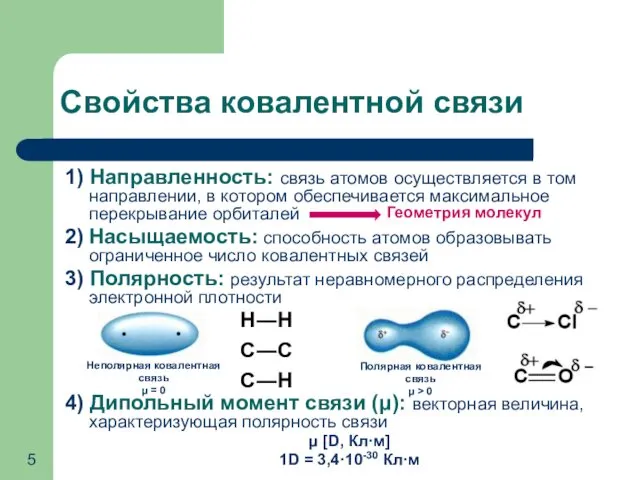
- 5. Свойства ковалентной связи 1) Направленность: связь атомов осуществляется в том направлении, в котором обеспечивается максимальное перекрывание
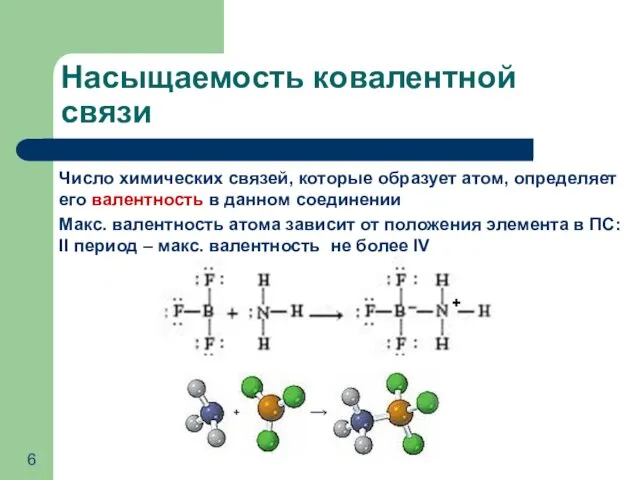
- 6. Число химических связей, которые образует атом, определяет его валентность в данном соединении Макс. валентность атома зависит
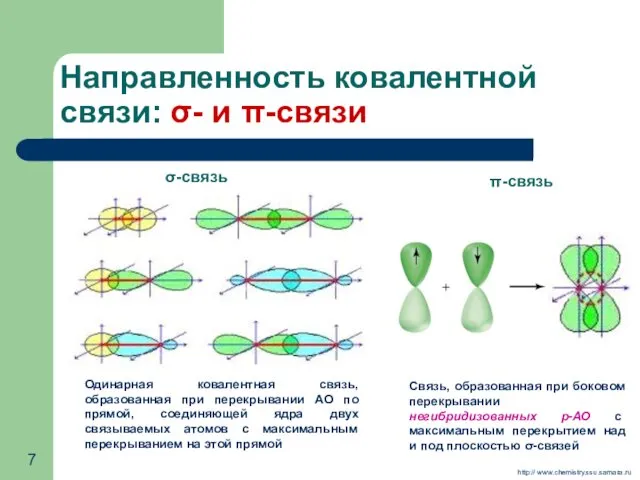
- 7. Направленность ковалентной связи: σ- и π-связи Связь, образованная при боковом перекрывании негибридизованных р-АО с максимальным перекрытием
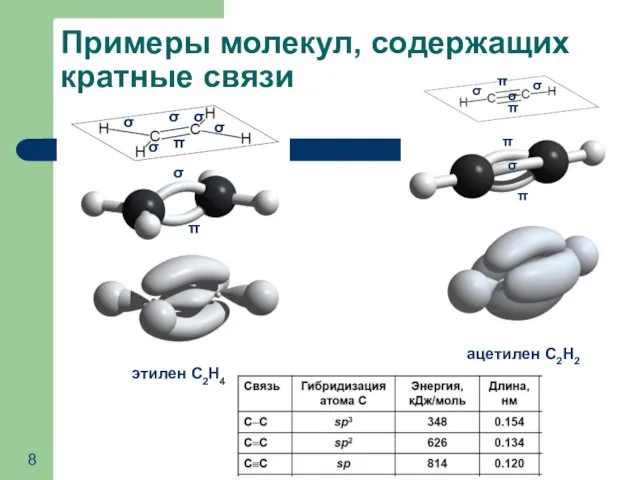
- 8. Примеры молекул, содержащих кратные связи
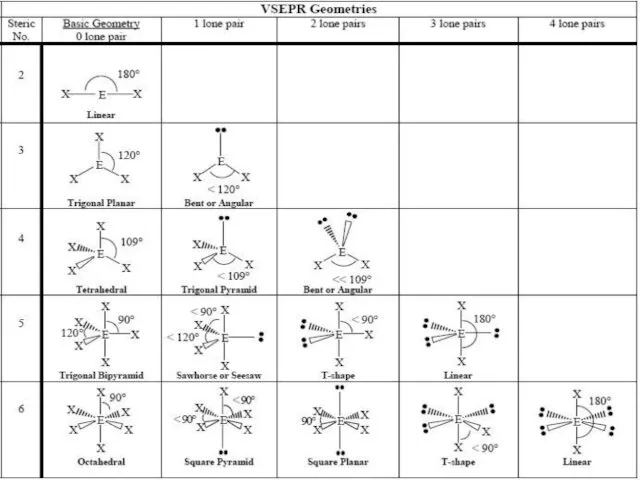
- 9. Геометрия молекул: Теория отталкивания электронных пар валентных орбиталей (ОЭПВО) Молекула принимает форму, при которой отталкивание внешних
- 10. Некоторые правила для ОЭПВО Атомы связываются так, чтобы сформировать октет Связывающие электронные пары занимают меньше пространства,
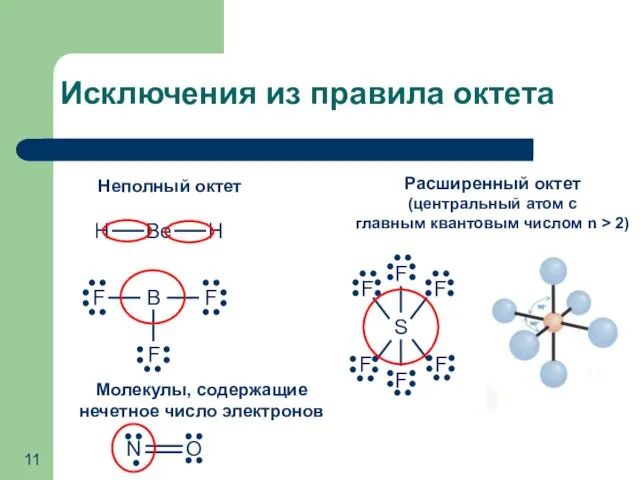
- 11. Исключения из правила октета Неполный октет Молекулы, содержащие нечетное число электронов Расширенный октет (центральный атом с
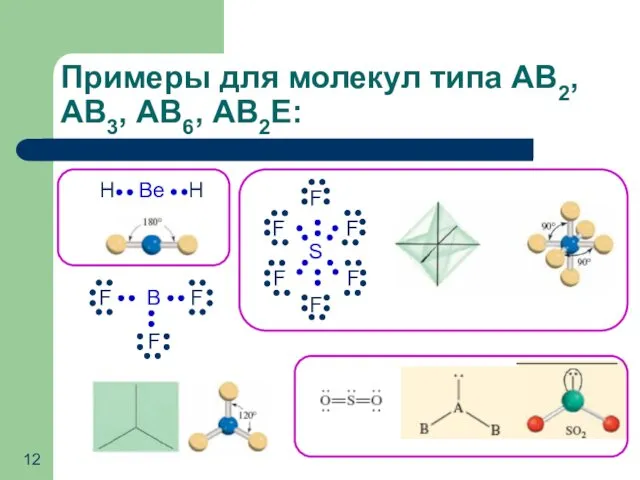
- 12. Примеры для молекул типа АВ2, АВ3, АВ6, АВ2Е: B
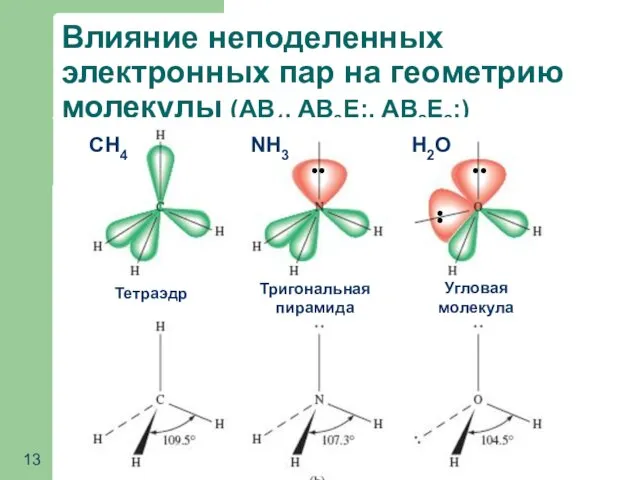
- 13. Влияние неподеленных электронных пар на геометрию молекулы (АВ4, АВ3Е:, АВ2Е2:) NH3 CH4 H2O
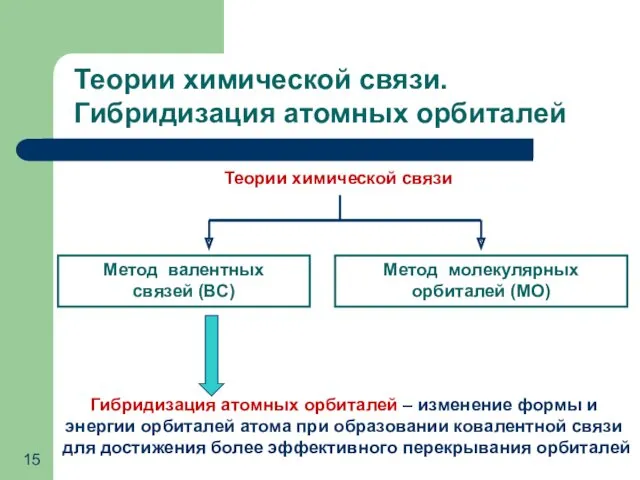
- 15. Теории химической связи Метод валентных связей (ВС) Метод молекулярных орбиталей (МО) Теории химической связи. Гибридизация атомных
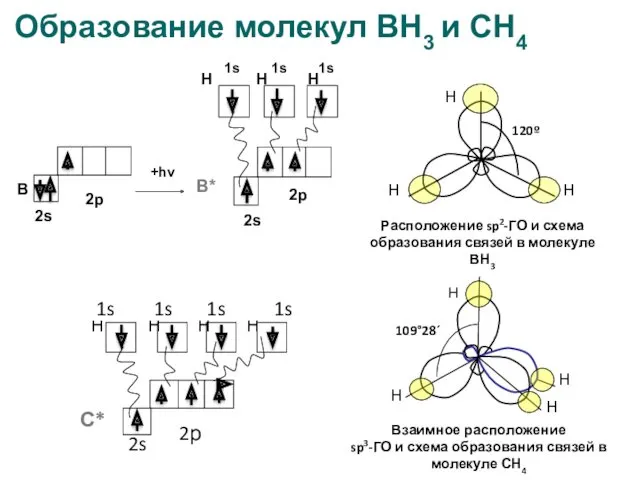
- 16. Основные положения теории гибридизации Гибридизуются орбитали атома, реализующего связи с другими атомами Гибридизуются АО с близкой
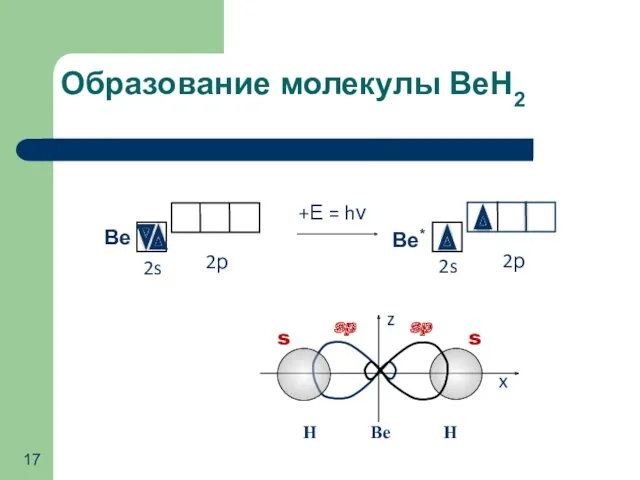
- 17. Образование молекулы ВеН2
- 18. Образование молекул ВН3 и СН4
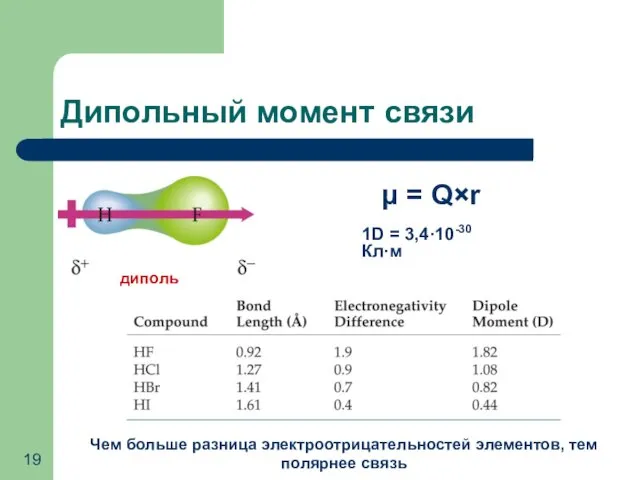
- 19. Дипольный момент связи Чем больше разница электроотрицательностей элементов, тем полярнее связь μ = Q×r диполь 1D
- 20. Полярные и неполярные молекулы Все ли молекулы, содержащие полярные связи полярны? Линейная молекула μ = 0
- 22. Скачать презентацию





 Социология в понимании социального мира
Социология в понимании социального мира Технология производства синтетических ионообменных материалов
Технология производства синтетических ионообменных материалов Альтернативные экологически чистые топлива для автомобилей
Альтернативные экологически чистые топлива для автомобилей Компанія Federal. Розподільче обладнання
Компанія Federal. Розподільче обладнання БезОпасный интернет
БезОпасный интернет Трансформатор. Режимы работы
Трансформатор. Режимы работы Возможности применения детектора лжи полиграф, для расследования коррупционных преступлений
Возможности применения детектора лжи полиграф, для расследования коррупционных преступлений Компьютерные вирусы
Компьютерные вирусы Учебная практика. Общественные отношения, подпадающие под воздействие норм публичного и частного права
Учебная практика. Общественные отношения, подпадающие под воздействие норм публичного и частного права Развитие речи детей 5-7 лет на логопедических занятиях по лексическим темам , с использованием матриц.
Развитие речи детей 5-7 лет на логопедических занятиях по лексическим темам , с использованием матриц. Витамины В1, В2 , В6
Витамины В1, В2 , В6 Машины для поверхностной обработки почвы
Машины для поверхностной обработки почвы Наши достижения. Клуб РЭМ робототехника и электромоделирование
Наши достижения. Клуб РЭМ робототехника и электромоделирование Профилактика стресса во время самоизоляции
Профилактика стресса во время самоизоляции Java for web. Java hosting
Java for web. Java hosting Постоянные магниты. Магнитное поле Земли
Постоянные магниты. Магнитное поле Земли Жалобы пациентов с патологией дыхательной системы
Жалобы пациентов с патологией дыхательной системы Основные классы неорганических соединений
Основные классы неорганических соединений Организация и деятельность маркетинговой службы предприятия
Организация и деятельность маркетинговой службы предприятия Портландцемент. Химический состав
Портландцемент. Химический состав Обращение. Знаки препинания при обращении
Обращение. Знаки препинания при обращении New Printing technologies in North America
New Printing technologies in North America День правил дорожного движения
День правил дорожного движения АВТОНОМНЫЙ ПУНКТ ПРИЕМА ГЕЛИОГЕОФИЗИЧЕСКОЙ ИНФОРМАЦИИ (АППИ-ГМ)
АВТОНОМНЫЙ ПУНКТ ПРИЕМА ГЕЛИОГЕОФИЗИЧЕСКОЙ ИНФОРМАЦИИ (АППИ-ГМ) ПРЕЗЕНТАЦИЯ для 11АБ КОНУС
ПРЕЗЕНТАЦИЯ для 11АБ КОНУС Технология построения семейного бюджета
Технология построения семейного бюджета Организация работы по развитию связной речи
Организация работы по развитию связной речи Программное обеспечение
Программное обеспечение