Содержание
- 2. Один опыт я ставлю выше, чем тысячу мнений, рожденных только воображением. М.В.Ломоносов.
- 3. Цели: 1. обучающая -Исследовать физические и химические свойства кислот, -Познакомиться с электрохимическим рядом напряжения металлов, показать
- 4. Цель урока: -Исследовать физические и химические свойства кислот, -Познакомиться с электрохимическим рядом напряжения металлов, показать принцип
- 5. Задачи: Закрепить умение наблюдать за химическими реакциями, описывать их и делать выводы. Продолжить формирование умений и
- 6. Актуализация Дайте определение классу кислот. Исходя из определения, выведите общую формулу кислот. Кислот достаточно много, а
- 7. Что нас объединяет?
- 8. Выберите и назовите формулы кислот 1) HCI, CO2 , NaOH , H2SO4 2) NaCI , H3PO4
- 9. Физические свойства жидкости (кроме кремниевой кислоты) без цвета без запаха кислые на вкус
- 10. Химические свойства «Кислоты – едкие вещества, вызывающие сильнейшие ожоги, разрушают органические вещества» - данное высказывание можно
- 11. Техника безопасности от строгой химички. Ты в хим. кабинет пришел Так запомни кроха Безопасность хорошо, Быть
- 12. Действие индикаторов H2SO4 + лакмус ? красный + ф.ф. ? бесцветный + м.о. ? красный
- 13. Электрохимический ряд напряжений
- 14. Взаимодействие с металлами ( до Н !) H2SO4 + Zn ? ZnSO4 + H2 ? H2SO4
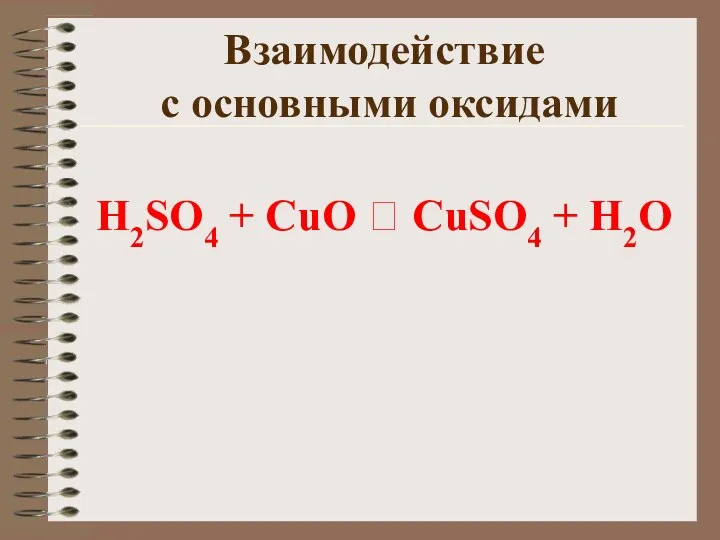
- 15. Взаимодействие с основными оксидами H2SO4 + CuO ? CuSO4 + H2O
- 16. Взаимодействие с растворимыми основаниями (щелочами) H2SO4 + 2NaOH ? Na2SO4 + 2H2O
- 17. Взаимодействие с нерастворимыми основаниями H2SO4 + Cu(OH)2? ? CuSO4 + 2H2О синий
- 18. Взаимодействие с солями H2SO4 + ВаCL2 ? BaSO4? + 2 HCL белый
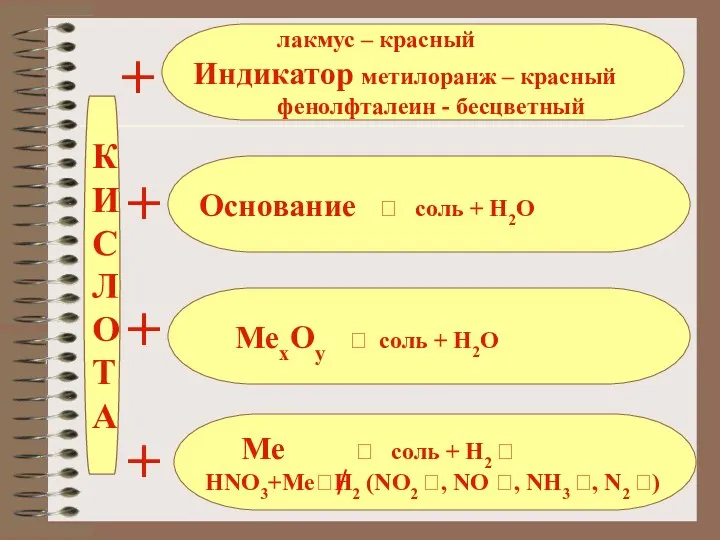
- 19. К И С Л О Т А Основание ? соль + Н2О лакмус – красный Индикатор
- 20. Ответы на тестирование 1. В 2. В 3. В 4. В 5. -- 6. А 7.
- 21. 5. Допишите возможные уравнения реакций: 6HCl + 2Al = 2AlCl3 + 3H2 H2SO4 + Hg =
- 22. дополнительное задание С какими из перечисленных веществ вступает в реакцию хлороводородная (соляная) кислота: Na2О, Сu, SO3,
- 23. 1. Определяем принадлежность заданных в условий веществ к соответствующим классам и тут же проверяем, реагируют ли
- 24. Интересные сведения о кислотах
- 25. Домашнее задание Пар. 45, решить стр.155 №3,4,5
- 27. Скачать презентацию






















 Проект По следам подвига. Поисковый отряд Гардемарины
Проект По следам подвига. Поисковый отряд Гардемарины Aero Master XP
Aero Master XP Аналитика конфликта
Аналитика конфликта Лист, его строение и значение
Лист, его строение и значение коллективно - творческий проект Широкая Масленица Дереклеева Н.И., Справочник классного руководителя 1-4 классы М.;2004.
коллективно - творческий проект Широкая Масленица Дереклеева Н.И., Справочник классного руководителя 1-4 классы М.;2004. мастер-класс Лепестки моей души
мастер-класс Лепестки моей души Собери компьютер сам
Собери компьютер сам Геополитические взаимоотношения между Россией и Великобританией
Геополитические взаимоотношения между Россией и Великобританией Исследовательская работа ученика 1 Б класса Хлапонина Захара Откуда у пчёл мёд?
Исследовательская работа ученика 1 Б класса Хлапонина Захара Откуда у пчёл мёд? Лучевая диагностика заболеваний почек
Лучевая диагностика заболеваний почек Деление натуральных чисел. 5 класс
Деление натуральных чисел. 5 класс Расслоение аневризмы аорты. Хирургическое лечение
Расслоение аневризмы аорты. Хирургическое лечение Балаково - Родина моя
Балаково - Родина моя Комплекс Талисман на Водном. Привлечение клиента
Комплекс Талисман на Водном. Привлечение клиента Designs of distributing devices
Designs of distributing devices Инвертор сварочный IW-160/7.1ATL
Инвертор сварочный IW-160/7.1ATL Weather - two word adjectives, collocations; causative verbs
Weather - two word adjectives, collocations; causative verbs Установка детских игровых (спортивных) площадок в г. о. Нальчик
Установка детских игровых (спортивных) площадок в г. о. Нальчик Мальчик с пальчик
Мальчик с пальчик Божественное песнопение, или о том, как славили Бога в Средние века
Божественное песнопение, или о том, как славили Бога в Средние века Фитнес-тур в курортный посёлок Нарочь
Фитнес-тур в курортный посёлок Нарочь Кайсын Кулиев
Кайсын Кулиев Конкурсная документация на изготовление торгового оборудования из дерева для магазинов сети СЕМЬЯ
Конкурсная документация на изготовление торгового оборудования из дерева для магазинов сети СЕМЬЯ Своя игра. География
Своя игра. География Илья Сергеевич Глазунов
Илья Сергеевич Глазунов Современный рынок интернет-рекламы в России
Современный рынок интернет-рекламы в России Методологія наукового дослідження
Методологія наукового дослідження Робот вычислитель
Робот вычислитель