Слайд 2

ХИМИЧЕСКАЯ СВЯЗЬ
ионная ковалентная металлическая водородная
Ме. + не Ме. Ме. +
Ме. Н+(молекула)
Na+1Cl -1 M° - nȇ ↔ Mⁿ̽ Н Н...О
О Н Н
не полярная полярная
не Ме(А) + не Ме(А) не Ме(А) + не Ме(Б)
F-F S=S N=N H + Cl → H : Cl
Слайд 3

ИОННАЯ СВЯЗЬ
1 ↑↓ s 1↑↓ s
2 ↑↓ s ↑↓ ↑↓
↑↓ p 2↑↓ s ↑↓ ↑↓ ↑↓ p
3 ↑ s 3 ↑↓ s ↑↓ ↑↓ ↑ p
Слайд 4

Ионная связь – это химическая связь, возникающая в результате превращения атомов
в ионы, при взаимодействии атомов типичных металлов и типичных неметаллов.
Металлы отдают внешние электроны и превращаются в положительные ионы, неметаллы принимают электроны и превращаются в отрицательные ионы. Ионы притягиваются друг к другу, образуя ионное соединение.
Слайд 5

КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ ХИМИЧЕСКАЯ СВЯЗЬ
Слайд 6

Ковалентная связь – это химическая связь, возникающая в результате образования общих
электронных пар.
Ковалентная одинарная связь – это химическая связь в которой атомы связанны между собой одной общей электронной парой.
Ковалентная неполярная связь – это хим. связь образованная при взаимодействии двух атомов одного и того же элемента-неметалла, так как общие электронные пары принадлежат обоим атомам в одинаковой степени и ни одной из них не будет избытка или недостатка отрицательного заряда, который несут электроны.
Чем больше общих электронных пар у атомов в молекуле, тем прочнее связанны они друг с другом и тем меньше расстояние между ядрами атомов.
Слайд 7

КОВАЛЕНТНАЯ ПОЛЯРНАЯ ХИМИЧЕСКАЯ СВЯЗЬ
Ковалентная полярная связь – это хим. связь образованная
между атомами различных элементов-неметаллов, то общая электронная пара будет принадлежать взаимодействующим атомом уже не в равной степени.
Слайд 8

Электроотрицательность (ЭО) – это способность атомов химического элемента смещать к себе
общие электронные пары, участвующие в образовании химической связи.
F, O, N, Cl, Br, I, S, C, Si, P, H.
ЭО уменьшается
В каждом периоде ЭО возрастает с увеличением порядкового номера элемента, а в каждой подгруппе – уменьшается.







 Краткая история средств связи и информации
Краткая история средств связи и информации Сульфаттау және сульфирлеу процестері. Сульфохлорлау арқылы алкилсульфонаттарды алу
Сульфаттау және сульфирлеу процестері. Сульфохлорлау арқылы алкилсульфонаттарды алу Разработка по внеурочной деятельности по курсу Я познаю мир тема Письма с фронта Диск
Разработка по внеурочной деятельности по курсу Я познаю мир тема Письма с фронта Диск Региональные налоги юридических лиц
Региональные налоги юридических лиц Подготовка к ГИА по химии
Подготовка к ГИА по химии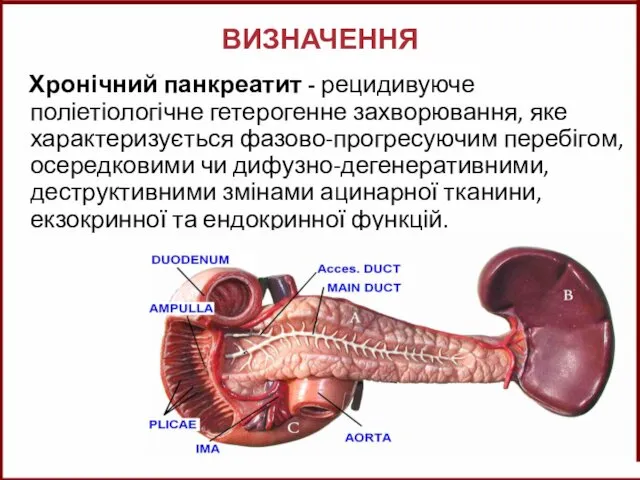 Хронічний панкреатит
Хронічний панкреатит класс
класс семинар для педагогов по психологическому комфорту в ДОУ Создание психологического комфорта в группах детского сада
семинар для педагогов по психологическому комфорту в ДОУ Создание психологического комфорта в группах детского сада Manual de Treinamento
Manual de Treinamento Japanese Culture!
Japanese Culture! Афанасий Никитин Хожение за три моря
Афанасий Никитин Хожение за три моря Всемирный день хлеба
Всемирный день хлеба Умный город. ИТМО хайпарк
Умный город. ИТМО хайпарк Русская матрешка. Приобщение детей к истокам русской народной культуры
Русская матрешка. Приобщение детей к истокам русской народной культуры Celebrity endorsement
Celebrity endorsement Священномученик Димитрий Павский
Священномученик Димитрий Павский Презентация к докладу Для чего ученику портфолио?
Презентация к докладу Для чего ученику портфолио? Презентация по теме Железо
Презентация по теме Железо Искусство в религиозной культуре
Искусство в религиозной культуре Характеристика лаборатории управление движением
Характеристика лаборатории управление движением Условия работы двигателей и требования предъявляемые к ним. Преимущества двигателей с последовательным возбуждением
Условия работы двигателей и требования предъявляемые к ним. Преимущества двигателей с последовательным возбуждением Аминокислоты
Аминокислоты Психология малых групп
Психология малых групп Робота вузлів пристрою управління каналом (ПК) (Заняття № 7.10)
Робота вузлів пристрою управління каналом (ПК) (Заняття № 7.10) Основные приемы использования GIMP
Основные приемы использования GIMP Thermal power plant
Thermal power plant Регистрация в Ресурсном центре по переходу на ФГОС
Регистрация в Ресурсном центре по переходу на ФГОС Секреты претензионного порядка: что нужно знать практикующему юристу
Секреты претензионного порядка: что нужно знать практикующему юристу