Слайд 2

Цель урока:
Разобраться, что такое «степень окисления»
Научиться находить степень окисления по формуле
Слайд 3

Поваренная соль NaCl
«Хлеб да соль» - пожелание добра
«Надо вместе съесть
пуд соли, чтобы узнать человека»
За какое время это можно сделать?
Пуд – 16 кг
3,5 – 5,5 кг в год
Примерно 2 года
Слайд 4

Влияние Na на организм человека
Хранят простое вещество «натрий» как Кощееву смерть.
Как
может повлиять натрий на организм человека?
Слайд 5

Влияние Cl2 на организм человека
Хлор – отравляющее вещество, применявшееся во время
первой мировой войны
Слайд 6

Образование сложного вещества
Na0 +11 2е,8е,1е
Cl0 +17 2e,8e,7e
Какой вид связи может
образоваться между этими атомами?
Na0 + Cl0 → Na+ + Cl- → Na+Cl-
Слайд 7
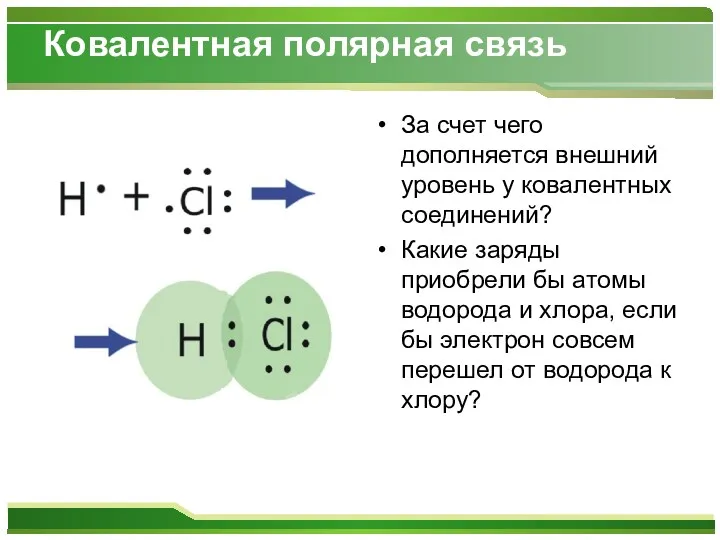
Ковалентная полярная связь
За счет чего дополняется внешний уровень у ковалентных соединений?
Какие заряды приобрели бы атомы водорода и хлора, если бы электрон совсем перешел от водорода к хлору?
Слайд 8
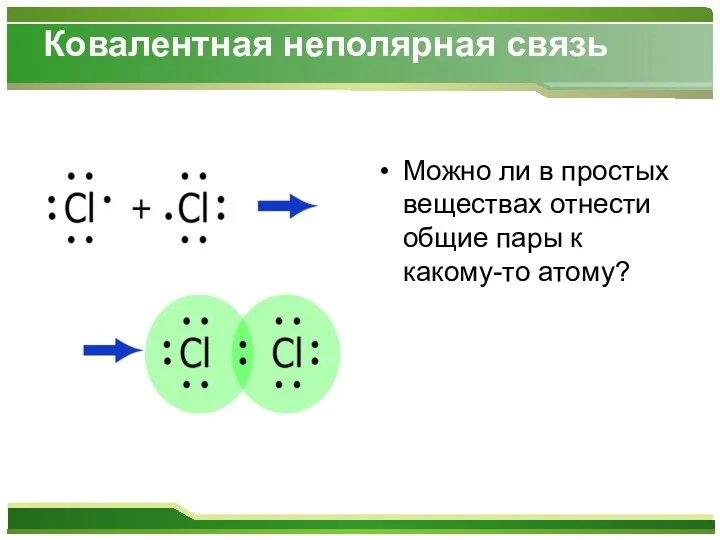
Ковалентная неполярная связь
Можно ли в простых веществах отнести общие пары к
какому-то атому?
Слайд 9
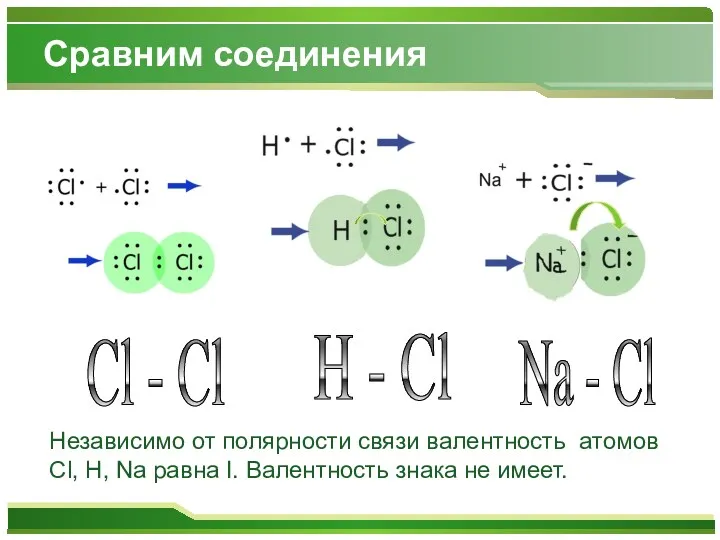
Сравним соединения
H - Cl
Cl - Cl
Na - Cl
Независимо от полярности связи
валентность атомов Cl, H, Na равна I. Валентность знака не имеет.
Слайд 10

Степень окисления –
это условный заряд атомов химических элементов в соединении,
вычисленный на основе предположения, что все соединения состоят из ионов
Слайд 11

Правила определения с.о.
С.о. атомов в простых веществах = 0
С.о. фтора =
-1
С.о. кислорода = -2 (кроме Н2О2-1, O+2F2)
С.о. водорода = +1 (кроме МеН-1)
С.о.Ме I, II, III групп = номеру группы
С.о неМе «+» = номеру группы
С.о. неМе «-» = 8 – номер группы
Слайд 12

Возможные с.о.
Положительная «+» равна числу отданных электронов. Максимальная с.о. равна номеру
группы
Отрицательная «-» равна числу принятых электронов. Минимальная с.о. равна 8 – номер группы
Нулевое значение с.о. имеют атомы в молекулах с неполярной связью
Слайд 13

Промежуточные с.о.
Рассмотрим возможные с.о. серы – S
Максимальная +6 SO3
Минимальная -2 H2S
Сера
может проявлять с.о. 0,+2,+4 – это промежуточные с.о.
Слайд 14

Определение с.о.
N2O3
На первом месте стоит элемент с «+» с.о., на втором
с «-»
У кислорода постоянная с.о.=-2
У азота переменная с.о.
x -2
N2O3
Стр.67 прочитайте как найти x
Слайд 15

Задание 1
Определите С.О. по формулам
Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3,
Cu2O














 Создание ситуации успеха на уроках
Создание ситуации успеха на уроках Накшатры Девы
Накшатры Девы Магниторезонансная томография
Магниторезонансная томография ОСЭ Презентация к уроку Справедливость
ОСЭ Презентация к уроку Справедливость Презентация Я будущий школьник
Презентация Я будущий школьник Повторение морфологии и орфографии. Интегрированный урок русский язык + информатика
Повторение морфологии и орфографии. Интегрированный урок русский язык + информатика Расчеты погрешностей механической обработки
Расчеты погрешностей механической обработки Доброта и нравственность в рассказе Астафьева Конь с розовой гривой
Доброта и нравственность в рассказе Астафьева Конь с розовой гривой Имя твое несу через года как святыню
Имя твое несу через года как святыню Оценочные работы, разведка месторождений, эксплуатационная разведка
Оценочные работы, разведка месторождений, эксплуатационная разведка Системы управления, защиты, автоматики, сигнализации промышленных предприятий
Системы управления, защиты, автоматики, сигнализации промышленных предприятий Индустриальный отчёт Субиндустрия Автотранспорт
Индустриальный отчёт Субиндустрия Автотранспорт Idiopathic (Immune) Thrombocytopenic Purpura
Idiopathic (Immune) Thrombocytopenic Purpura Комментарии к чертежам
Комментарии к чертежам История ёлочной игрушки
История ёлочной игрушки Общешкольное родительское собрание
Общешкольное родительское собрание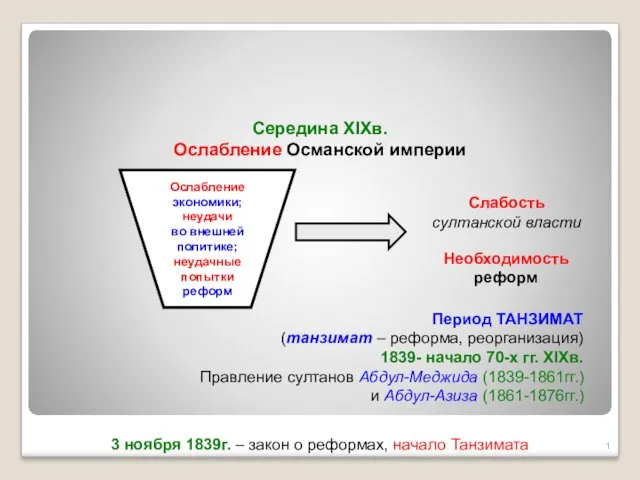 Танзимат. Середина XIXв. Ослабление Османской империи
Танзимат. Середина XIXв. Ослабление Османской империи Робототехника. Системы дистанционного управления. Технологические основы и направления роботизации
Робототехника. Системы дистанционного управления. Технологические основы и направления роботизации Костюмы для Ани и Вани
Костюмы для Ани и Вани Познавательное развитие дошкольников в изобразительной деятельности
Познавательное развитие дошкольников в изобразительной деятельности КРОССВОРД ПЕРВОНАЧАЛЬНЫЕ ПОНЯТИЯ
КРОССВОРД ПЕРВОНАЧАЛЬНЫЕ ПОНЯТИЯ Моделирование алгоритмов вейвлет-преобразования. Вейвлет-фильтры и их характеристики
Моделирование алгоритмов вейвлет-преобразования. Вейвлет-фильтры и их характеристики Регистрация религиозных объединений
Регистрация религиозных объединений Закрепление. Умножение и деление
Закрепление. Умножение и деление Учитель года 2015-2016
Учитель года 2015-2016 Учение о биосфере. (Лекция 2)
Учение о биосфере. (Лекция 2) Презентация Внеклассная работа по географии и экологии
Презентация Внеклассная работа по географии и экологии Эфиры и жиры
Эфиры и жиры