Содержание
- 2. Электронные конфигурации элементов VА-группы …ns2np3
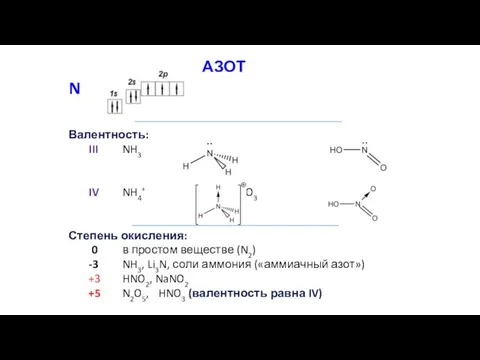
- 3. N Валентность: III NH3 HNO2 IV NH4+ HNO3 Степень окисления: 0 в простом веществе (N2) -3
- 4. Р основное состояние возбужденное состояние Валентность: III PH3, P4O6, AsH3 V H3PO4, P4O10 Степень окисления: 0
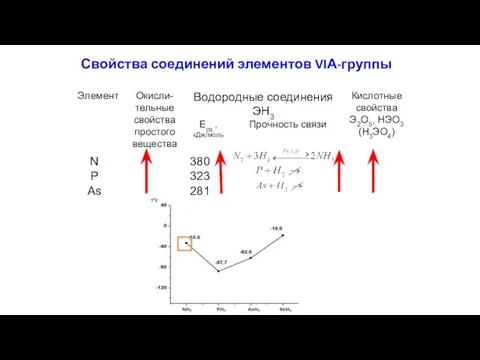
- 5. Свойства соединений элементов VIА-группы
- 6. РАСПРОСТРАНЕННОСТЬ АЗОТА В ПРИРОДЕ В природе азот встречается в как свободном виде, так и в виде
- 7. Физические свойства азота tпл. tкип. Eсв, кДж/моль N2 -210 o C -196o C 946 (ниже, чем
- 8. Окислительные свойства Азот проявляет окислительные свойства во всех реакциях, кроме реакций с O2 и F2 Взаимодействие
- 9. Восстановительные свойства, взаимодействие с кислородом С кислородом реагирует при температуре 3000 о С: N2 + O2
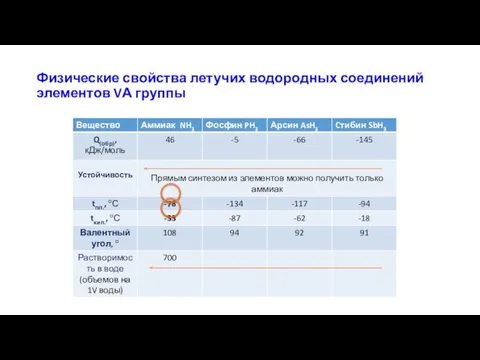
- 10. Физические свойства летучих водородных соединений элементов VА группы
- 11. Аммиак – бесцветный газ с резким запахом 3 %-ный раствор – нашатырный спирт 25 %-ный раствор
- 12. Химические свойства аммиака NH3 является слабым основанием (Kb = 1,8·10-5): NH3 проявляет за счет азота только
- 13. Задание Какие из перечисленных факторов увеличивают скорость синтеза аммиака, а какие способствуют смещению равновесия реакции вправо:
- 14. Соли аммония NH4Cl – сублимируется при 350 оС Сульфиды, карбонаты летучи NH4NO3 – удобрение, входит в
- 15. - «веселящий газ» Бесцветный газ со слабым приятным запахом и сладковатым вкусом. Несолеобразующий оксид. tкип. =
- 16. оксид азота(II) Бесцветный газ. tпл. = -164 оС tкип. = -152 оС Несолеобразующий оксид. Поддерживает горение.
- 17. азотистый ангидрид Красно-бурый газ, при -30 оС конденсируется в синюю жидкость. Четкой tкип. не имеет, при
- 18. - оксид азота(IV) Газ бурого цвета. «Лисий хвост»
- 19. NO2, N2O4 При +22 оС NO2 конденсируется в бурую жидкость, при -10 оС образуются бесцветные кристаллы
- 20. Получение NO2 В промышленности: В лаборатории: NO2 является сильным окислителем, поддерживает горение: При взаимодействии с водой
- 21. - оксид азота(V), азотный ангидрид Бесцветное кристаллическое вещество. Кислотный оксид. Очень неустойчив, при нагревании разлагается со
- 22. АЗОТНАЯ КИСЛОТА HNO3 – бесцветная жидкость с резким запахом, дымящая на воздухе за счет протекания реакции:
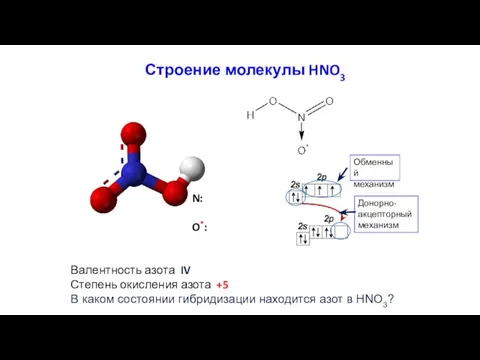
- 23. Строение молекулы HNO3 N: O*: Валентность азота IV Степень окисления азота +5 В каком состоянии гибридизации
- 24. Физические свойства HNO3
- 25. Продукты взаимодействия HNO3 с металлами Чем ниже концентрация кислоты и чем активнее металл, тем глубже восстанавливается
- 26. HNO3 – окислитель Концентрированная азотная кислота без нагревания не реагирует с Fe, Al и Cr. При
- 27. Царская водка Смесь концентрированной азотной и соляной кислот называется царской водкой. В ней растворяются золото и
- 28. Получение HNO3 Производство HNO3 включает три стадии: Каталитическое окисление аммиака до оксида азота(II): 4NH3 + 5O2
- 29. НИТРАТЫ Нитраты щелочных, щелочноземельных металлов и аммония называются селитрами: NaNO3 KNO3 Ca(NO3)2 NH4NO3 - Термическое разложение
- 30. Окислительные свойства нитратов Черный порох Нитрат калия, наряду с углем и серой, входит в состав черного
- 31. ФОСФОР Фосфор природе встречается только в виде соединений Основные соединения фосфора - фосфориты и апатиты, основной
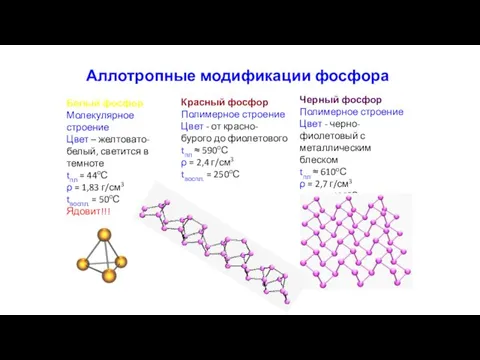
- 32. Аллотропные модификации фосфора Белый фосфор Молекулярное строение Цвет – желтовато-белый, светится в темноте tпл = 44оС
- 33. Получение фосфора В парáх существует только Р4
- 34. Химические свойства фосфора Окислительные свойства При нагревании фосфор взаимодействует с активными металлами: Восстановительные свойства Окисляется кислородом:
- 35. Оксид фосфора(V), фосфорный ангидрид P2O5 (P4O10) P2O5 - белое кристаллическое вещество (tпл > 300 оС). Расплывается
- 36. Ортофосфорная кислота H3PO4 При растворении в воде P2O5 образует слабую трехосновную фосфорную кислоту (H3PO4, tпл =
- 37. Получение фосфорной кислоты В промышленности: Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4
- 38. Неметаллы IVА-группы. Углерод, кремний …ns2np2
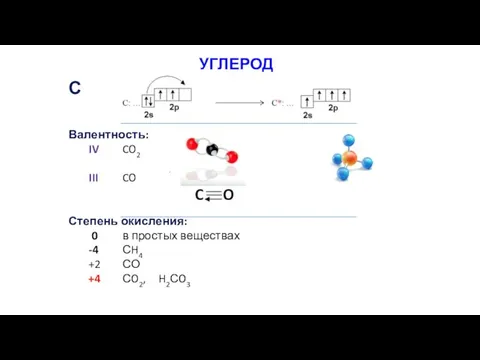
- 39. С Валентность: IV CO2 CH4 III CO Степень окисления: 0 в простых веществах -4 СH4 +2
- 40. Si основное состояние возбужденное состояние Валентность: IV Si, SiH4, SiO2, H2SiO3 Степень окисления: 0 в простом
- 41. Аллотропные модификации углерода Алмаз Графит Карбин
- 42. Бриллиант «Шах» (88,7 карата)
- 43. Алмаз «Куллинан» (3106 карат)
- 44. Большая звезда Африки (530,2 карат)
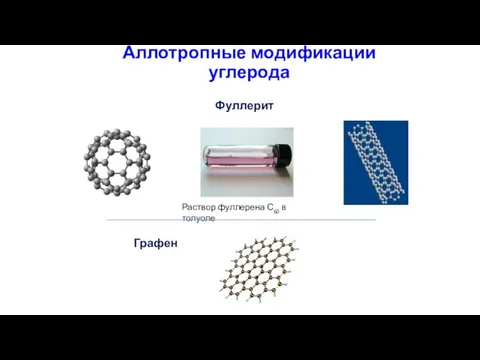
- 45. Аллотропные модификации углерода Фуллерит Графен Раствор фуллерена С60 в толуоле
- 46. Применение углерода Алмаз Драгоценные камни, режущие и абразивные материалы Графит Карандаши, электроды, тигли для плавки металлов
- 47. Оксид углерода(II), угарный газ СО Бесцветный газ (tкип. = -102 оС), без запаха, очень ядовит, образуется
- 48. Оксид углерода(IV), углекислый газ СО2 Бесцветный газ, без запаха, не поддерживает горение и дыхание, образуется при
- 49. Физические свойства СО2 Содержание в воздухе – 0,03 об. % В атмосфере Венеры – 95 %
- 50. Химические свойства СО2 Взаимодействует: с водой СО2 + Н2О ⇄ Н2СО3 растворами щелочей и твердыми щелочами
- 51. Получение СО2 1. Сжигание угля и органических веществ: 2. Разложение известняка: 3. В лаборатории получают действием
- 52. Угольная кислота Н2СО3 CO2 – кислотный оксид При растворении в воде около 1 % растворенного СО2
- 53. Химические свойства H2CO3 Со щелочами образует два типа солей – карбонаты и гидрокарбонаты: Вытесняет кремниевую кислоту
- 54. Что такое сода? Кальцинированная сода Na2CO3 Кристаллическая сода Na2CO3 ·10H2O Питьевая сода NaHCO3 Каустическая сода NaOH
- 55. Жесткость воды обусловлена наличием в ней ионов Ca2+ и Mg2+ Временная жесткость: Обусловлена присутствием гидрокарбонатов кальция
- 56. Накипь
- 57. Устранение временной жесткости Необходимо удалить из воды ионы Ca2+ и Mg2+ А) Кипячение: Б) Взаимодействие с
- 58. Постоянная (некарбонатная) жесткость Обусловлена присутствием хлоридов и сульфатов кальция и магния Способы устранения Невозможно удалить кипячением.
- 59. Жесткость воды
- 60. Понизить жесткость воды (20 оС) можно, добавив в нее: А) Na2CO3 Б) MgCl2 В) KHCO3 Г)
- 61. Понизить жесткость воды (20 оС) можно, добавив в нее: Ba(OH)2 Mg(HCO3)2 K3PO4 Другие варианты ЦТ-2016
- 62. Кремний Распространенность в природе В встречается только в виде соединений (силикаты). Занимает второе место по распространенности
- 63. Физические свойства Вещество серо-стального цвета с металлическим блеском, обладает полупроводниковыми свойствами. Атомная алмазоподобная кристаллическая структура. tпл.
- 64. Химические свойства кремния Растворяется в плавиковой кислоте: НЕ реагирует с концентрированными HNO3 и H2SO4! Растворяется в
- 65. Оксид кремния (IV), кремнезем, кварц Белое кристаллическое тугоплавкое вещество, tпл. = 1713 оС. Атомная кристаллическая структура:
- 66. Химические свойства SiO2 Взаимодействует с концентрированными растворами щелочей и твердыми щелочами: Взаимодействует с твердыми карбонатами: Взаимодействует
- 67. Кремниевая кислота H2SiO3 Твердое вещество, не растворяется в воде. Слабая двухосновная кислота (слабее угольной): Na2SiO3 +
- 68. Химические свойства H2SiO3 Разлагается при нагревании, образуя силикагель: Реагирует со щелочами образуя силикаты: Растворимые силикаты (Na2SiO3,
- 69. Стекло Na2CO3 + CaCO3 + 6SiO2 = Na2O⋅CaO⋅6SiO2 + 2CO2↑ сода известняк песок стекло
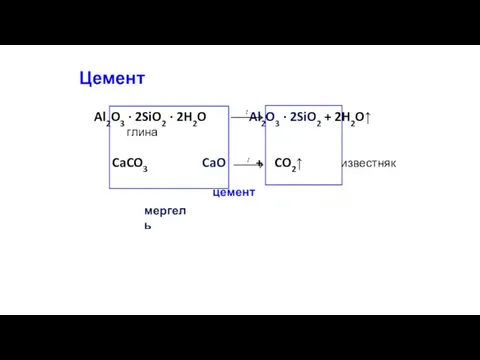
- 70. Цемент Al2O3 · 2SiO2 · 2H2O Al2O3 · 2SiO2 + 2H2O↑ глина CaCO3 CaO + CO2↑
- 73. Скачать презентацию






























































 День знаний(презентация)
День знаний(презентация) Республика Казахстан
Республика Казахстан Электроэнергетика. Альтернативные источники энергии
Электроэнергетика. Альтернативные источники энергии Аналоговый датчик линии
Аналоговый датчик линии Лего-конструирование в начальной школе
Лего-конструирование в начальной школе Ионная химическая связь. 8 класс.
Ионная химическая связь. 8 класс. Презентация к уроку в 10 класса Географические законы и модели ( к учебнику В.Н.Холиной География)
Презентация к уроку в 10 класса Географические законы и модели ( к учебнику В.Н.Холиной География) 第六节课
第六节课 Русь в XIV-XV веках
Русь в XIV-XV веках Двигатели боевых самолётов России
Двигатели боевых самолётов России Здоровье ребенка в ваших руках.
Здоровье ребенка в ваших руках. Ценовая политика фирмы
Ценовая политика фирмы Иудаизм
Иудаизм Презентация (продолжение) к уроку:Степень.Квадрат и куб числа
Презентация (продолжение) к уроку:Степень.Квадрат и куб числа Холодная листовая штамповка
Холодная листовая штамповка Характеристика стран Зарубежной Азии
Характеристика стран Зарубежной Азии элекронная игра Задачки от Смешариков
элекронная игра Задачки от Смешариков Схемы газопроводов и газового оборудования газорегуляторных пунктов
Схемы газопроводов и газового оборудования газорегуляторных пунктов Фармакогнозия как наука
Фармакогнозия как наука Воронка продаж
Воронка продаж Блеск и сила здоровых волос
Блеск и сила здоровых волос Методы повышения нефтеотдачи пластов
Методы повышения нефтеотдачи пластов Наш любимый детский сад!
Наш любимый детский сад! Сплавы металлов
Сплавы металлов творческая мастерская (2) - копия
творческая мастерская (2) - копия Технология закладки картофеля на хранение
Технология закладки картофеля на хранение Яшелчәләр, җиләк-җимешләр темасына презентация
Яшелчәләр, җиләк-җимешләр темасына презентация Вирусы гепатитов
Вирусы гепатитов