Содержание
- 2. Основные положения ТЭД При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. NaCl
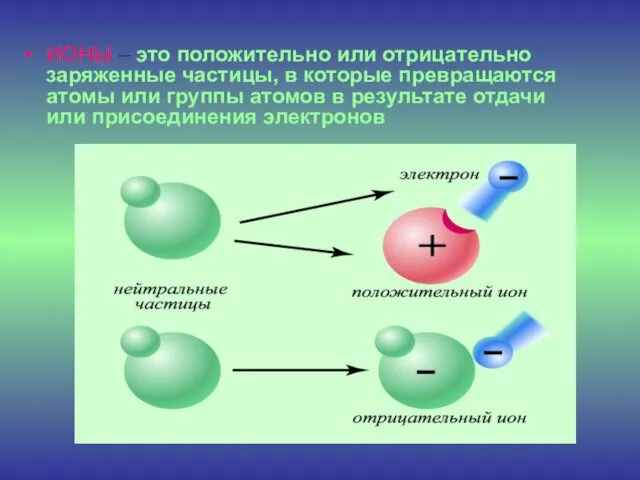
- 3. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
- 4. ЭЛЕКТРОННЫЕ ФОРМУЛЫ +11Na0 2ē 8ē 1ē +11Na+ 2ē 8ē атом ион +17Cl0 2ē 8ē 7ē +17Cl0
- 5. ИОНЫ (по составу) ПРОСТЫЕ Например: Cl- K+ СЛОЖНЫЕ Например: NO3- SO42-
- 6. Основные положения ТЭД 2. Причиной диссоциации электролита в водном растворе является его гидратация, т.е. взаимодействие электролита
- 7. ИОНЫ (по наличию водной оболочки) ГИДРАТИРОВАННЫЕ Например: В растворах и кристаллогидратах CuSO4 * 5H2O Na2SO4* 10H2O
- 8. Основные положения ТЭД 3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника
- 9. ИОНЫ (по знаку заряда) КАТИОНЫ положительно заряженные частицы АНИОНЫ отрицательно заряженные частицы
- 10. Основные положения ТЭД 4. Электролитическая диссоциация – процесс обратимый для слабых электролитов. Наряду с процессом диссоциации
- 11. Основные положения ТЭД 5. Не все электролиты в одинаковой мере диссоциируют на ионы.
- 12. степень диссоциации Отношение числа молекул электролита, распавшихся на ионы к общему числу молекул в растворе
- 13. Факторы, влияющие на степень диссоциации 1) природа электролита и растворителя 2) температура 3) концентрация электролита
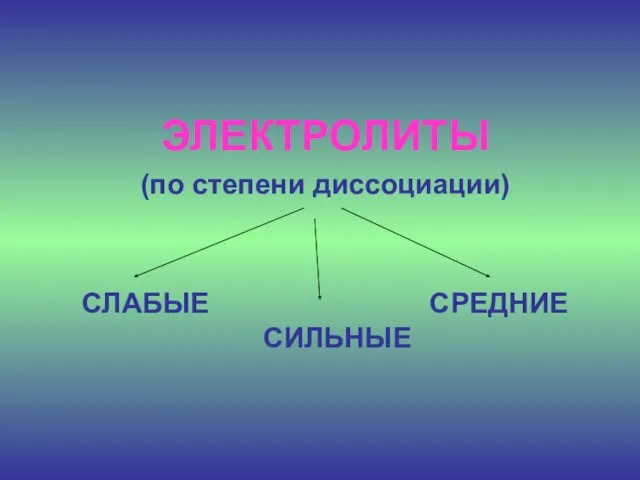
- 14. ЭЛЕКТРОЛИТЫ (по степени диссоциации) СЛАБЫЕ СРЕДНИЕ СИЛЬНЫЕ
- 15. Основные положения ТЭД 6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при
- 16. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов) КИСЛОТЫ ОСНОВАНИЯ СОЛИ
- 17. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) HCl 2) HNO3 3) Н2SiO3
- 18. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Кислоты – это электролиты, которые диссоциируют на катионы и анионы
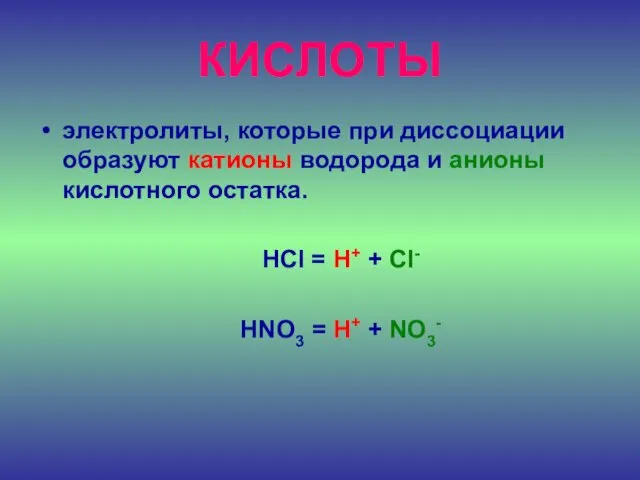
- 19. КИСЛОТЫ электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. HCl = H+ +
- 20. Многоосновные кислоты диссоциируют ступенчато H3PO4 (фосфорная кислота) 1) Образование дигидрофосфат-ионов H3PO4 ↔ H+ + H2PO4- 2)
- 21. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaOH 2) KOH 3) Fe(OH)2
- 22. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Основания – это электролиты, которые диссоциируют на катионы и анионы
- 23. ОСНОВАНИЯ электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. NaOH = Na+ + OH- KOH
- 24. Многокислотные основания диссоциируют ступенчато Ba(OH)2 (гидроксид бария) 1) Образование гидроксо-ионов бария Ba(OH)2 ↔ OH- + BaOH+
- 25. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaCl 2) KNO3 3) BaSO4
- 26. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Cоли – это электролиты, которые диссоциируют на катионы и анионы
- 27. СОЛИ электролиты, которые при диссоциации образуют катионы металла (или аммония NH4) и анионы кислотных остатков. K3PO4
- 29. Скачать презентацию























 Культы. Как распознать
Культы. Как распознать Трудности адаптации пятиклассников.
Трудности адаптации пятиклассников. Глобальные проблемы человечества и пути их решения. Экологическая проблема
Глобальные проблемы человечества и пути их решения. Экологическая проблема Великобритания: культура и искусство. Элективный курс. 9-й класс.
Великобритания: культура и искусство. Элективный курс. 9-й класс. Особенности политического развития в мире
Особенности политического развития в мире Родительское собрание (1 класс)Трудности обучения письму и чтению в начальной школе.
Родительское собрание (1 класс)Трудности обучения письму и чтению в начальной школе. Химические свойства металлов
Химические свойства металлов о.ю
о.ю Слова с суффиксом -ость. Сопоставление пар слов с противоположным значением.
Слова с суффиксом -ость. Сопоставление пар слов с противоположным значением. Фруктовая и овощная батарейка
Фруктовая и овощная батарейка Притча Задача учителя
Притча Задача учителя Эмоции и чувства человека и животных
Эмоции и чувства человека и животных олимпиада по олимпийским играм
олимпиада по олимпийским играм Угольная промышленность России
Угольная промышленность России Варгашинский район на карте Курганской области
Варгашинский район на карте Курганской области Покрытосеменные, или цветковые растения. (Часть 2)
Покрытосеменные, или цветковые растения. (Часть 2) Федеральный стандарт оценки ФСО-9. Оценка для целей залога
Федеральный стандарт оценки ФСО-9. Оценка для целей залога Электронное портфолио
Электронное портфолио Социальная проблема - игромания
Социальная проблема - игромания Образование первых государств
Образование первых государств Давлат умумий ўрта таълим муассасалари ўқувчиларини замонавий ягона мактаб формаси билан таъминлаш
Давлат умумий ўрта таълим муассасалари ўқувчиларини замонавий ягона мактаб формаси билан таъминлаш Родительское собрание Учим детей мыслить
Родительское собрание Учим детей мыслить 2_5325665765213361055
2_5325665765213361055 Сальвадор Дали
Сальвадор Дали Arany nagykőrösi ballada korszaka
Arany nagykőrösi ballada korszaka Строительные машины для земляных работ
Строительные машины для земляных работ Высказывания со словами есть, существует, некоторые.
Высказывания со словами есть, существует, некоторые. Psychophysik Hören
Psychophysik Hören