Содержание
- 2. История и этапы развития метода Электрофорез – движение заряженных частиц растворе под действием электрического поля История:
- 3. Электрофоретическая подвижность μ = электрофоретическая подвижность q = заряд частицы η = вязкость раствора r =
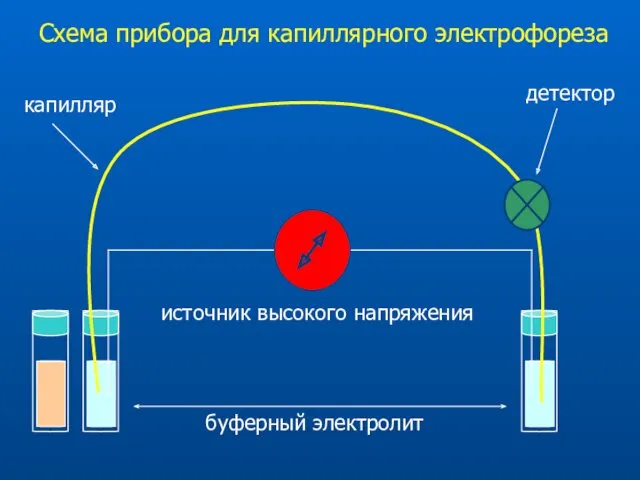
- 4. Схема прибора для капиллярного электрофореза
- 5. Скорость миграции по капилляру Скорость миграции: Где: v = скорость миграции иона в электрическом поле (см
- 6. Эффективность в электрофорезе не зависит от длины капилляра! Уравнение Ван-Деемтера: A = 0 (капилляр узкий, нет
- 7. Строение капилляра Трубка из плавленного кварца со строго фиксированными диаметрами. Внешний диаметр 375 мкм, внутренний –
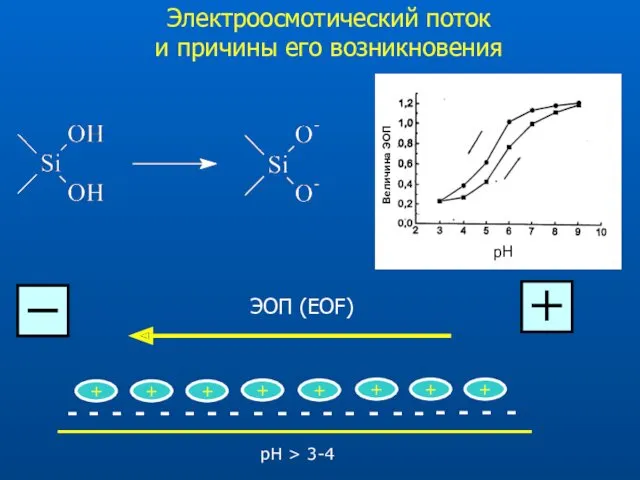
- 8. Электроосмотический поток и причины его возникновения
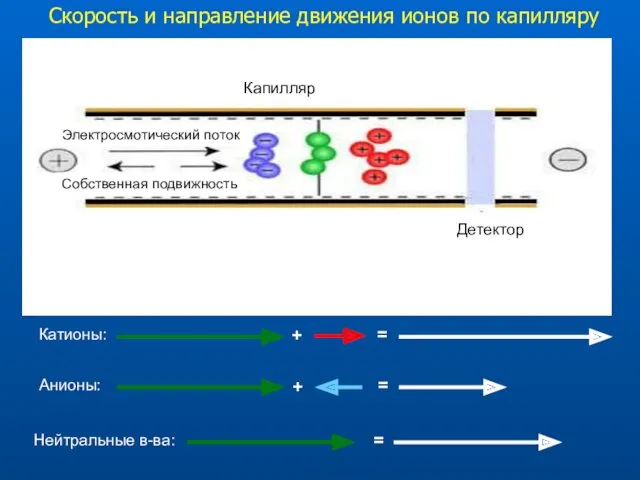
- 9. Детектор Капилляр Электросмотический поток Собственная подвижность Скорость и направление движения ионов по капилляру
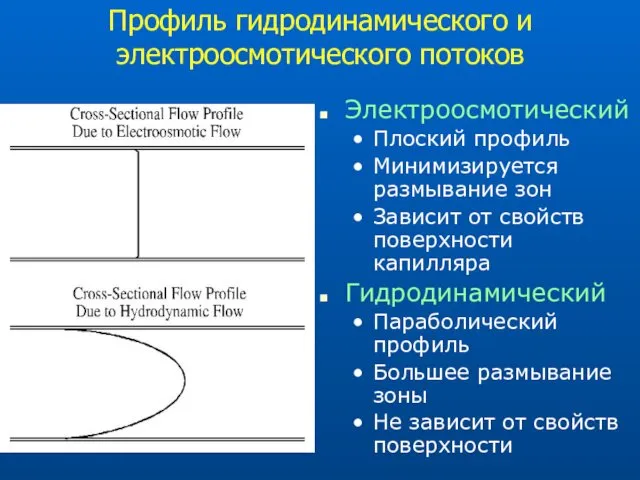
- 10. Профиль гидродинамического и электроосмотического потоков Электроосмотический Плоский профиль Минимизируется размывание зон Зависит от свойств поверхности капилляра
- 11. Выделение тепла капилляром Капилляр работает как сопротивление Чем больше ток, тем больше выделение тепла Зависимость силы
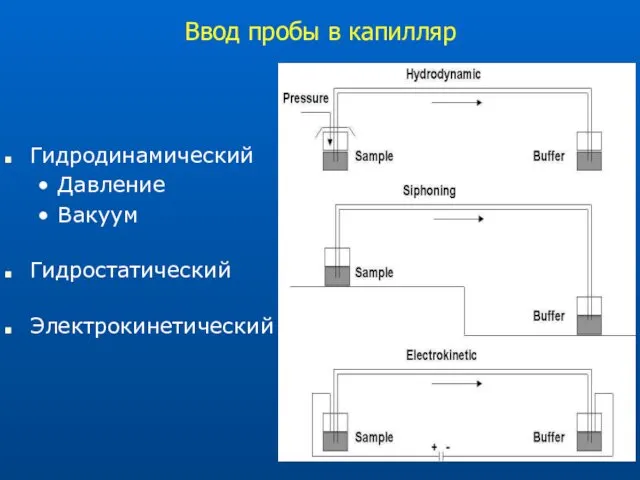
- 12. Ввод пробы в капилляр Гидродинамический Давление Вакуум Гидростатический Электрокинетический
- 13. Детектирование в капиллярном электрофорезе Капилляр имеет малый объем, следовательно объем вводимой пробы очень мал (нанолитры) Специальные
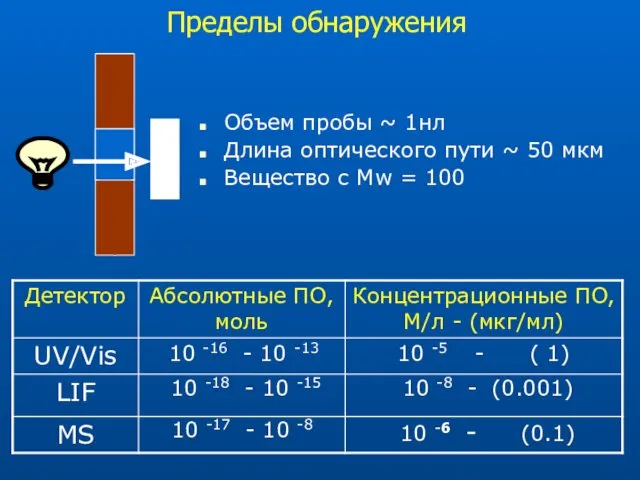
- 14. Пределы обнаружения Объем пробы ~ 1нл Длина оптического пути ~ 50 мкм Вещество с Mw =
- 15. Оптимизация в капиллярном электрофорезе pH Первое, что надо варьировать Влияет на ЭОП и подвижность (заряд) Органический
- 16. Достоинства капиллярного электрофореза Очень высокая эффективность (до 6 млн. тт) Требуемый объем пробы (1-10 мкл) Быстрое
- 17. Недостатки капиллярного электрофореза Часто недостаточная чувствительность Хуже воспроизводимость по сравнению с хроматографией Сложно контролировать величину ЭОП
- 18. Капиллярный зонный электрофорез (CZE) Мицеллярная электрокинетическая хроматография (MEKC) Микроэмульсионная электрокинетическая хроматография (MEEKC) Капиллярная электрохроматография с заполненными
- 19. Капиллярный зонный электрофорез
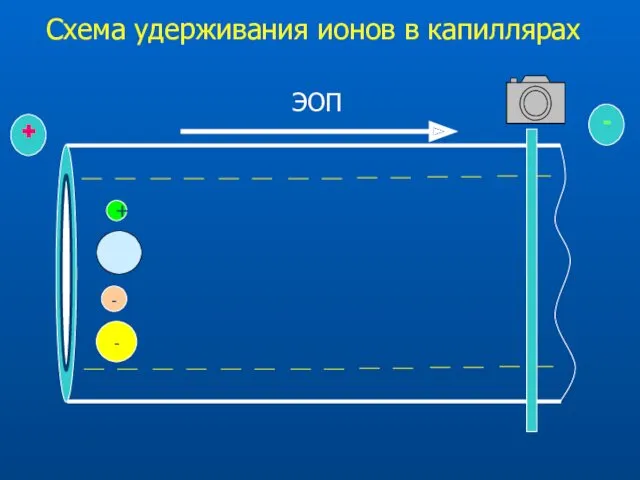
- 20. Схема удерживания ионов в капиллярах + - -
- 21. Разделяются ТОЛЬКО заряженные соединения. Направления движения катионов и анионов различны. Подвижности ионов отличаются в зависимости от
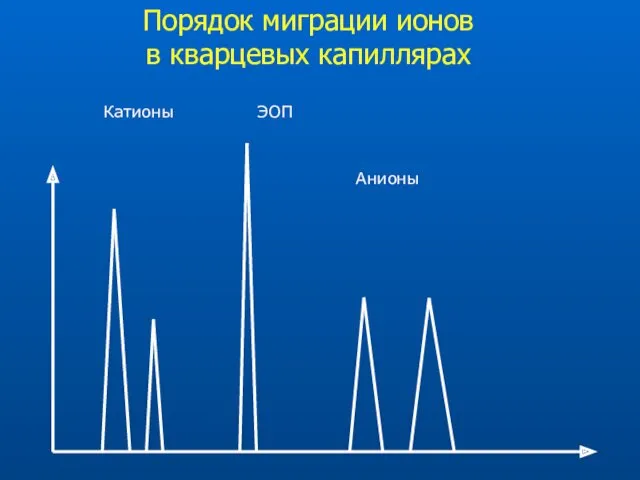
- 22. Порядок миграции ионов в кварцевых капиллярах
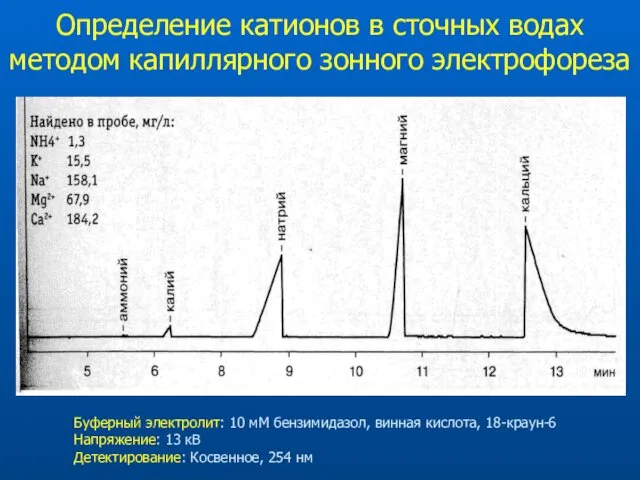
- 23. Определение катионов в сточных водах методом капиллярного зонного электрофореза Буферный электролит: 10 мМ бензимидазол, винная кислота,
- 24. Хорошие начальные условия для КЗЭ: Капилляр: 75 мкм внутренний диаметр, 60 см длина Электролит: Фосфатный или
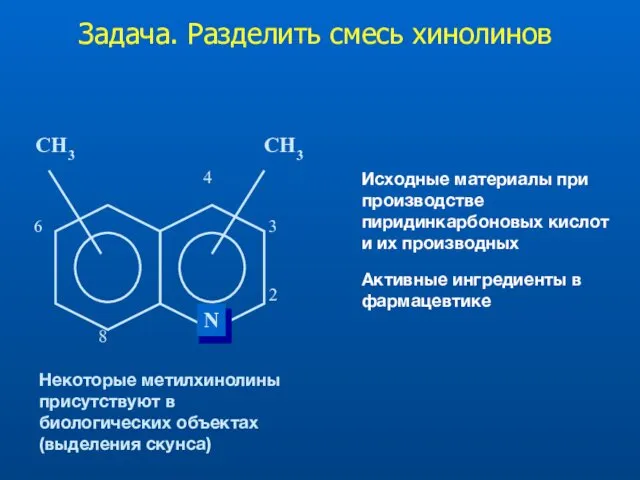
- 25. Задача. Разделить смесь хинолинов Исходные материалы при производстве пиридинкарбоновых кислот и их производных Активные ингредиенты в
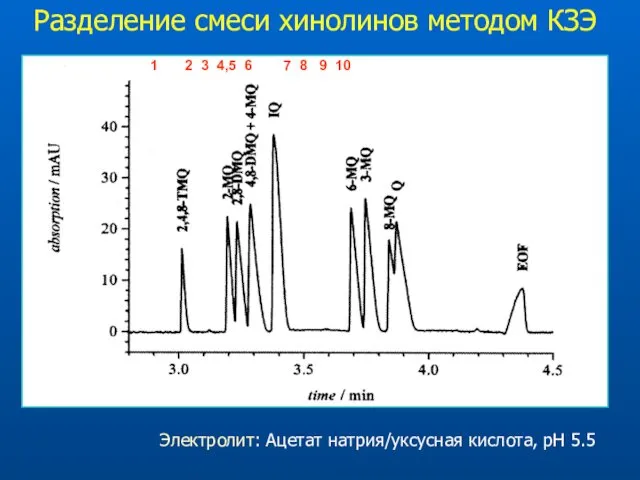
- 26. Разделение смеси хинолинов методом КЗЭ Электролит: Ацетат натрия/уксусная кислота, pH 5.5
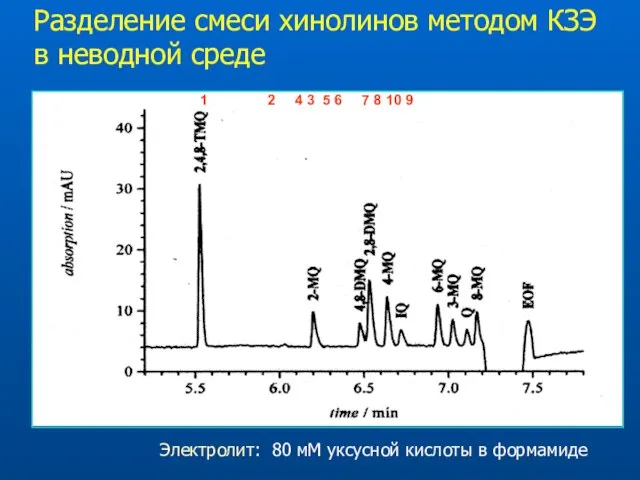
- 27. Разделение смеси хинолинов методом КЗЭ в неводной среде Электролит: 80 мМ уксусной кислоты в формамиде
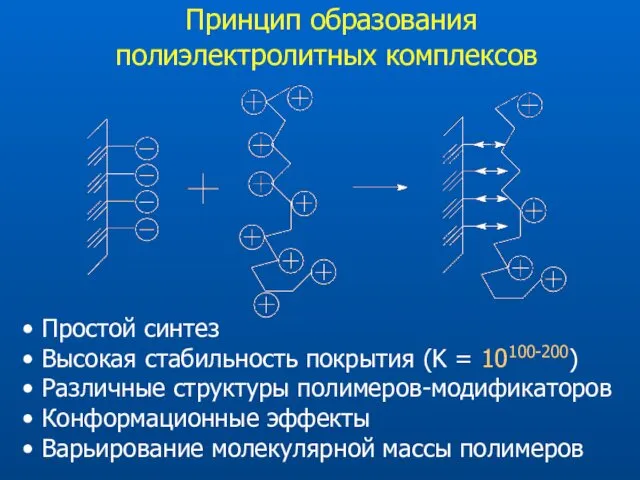
- 28. Принцип образования полиэлектролитных комплексов Простой синтез Высокая стабильность покрытия (K = 10100-200) Различные структуры полимеров-модификаторов Конформационные
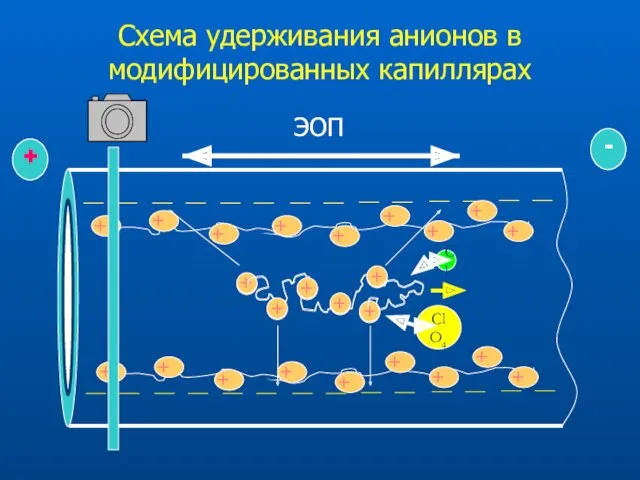
- 29. Схема удерживания анионов в модифицированных капиллярах Cl ClO4
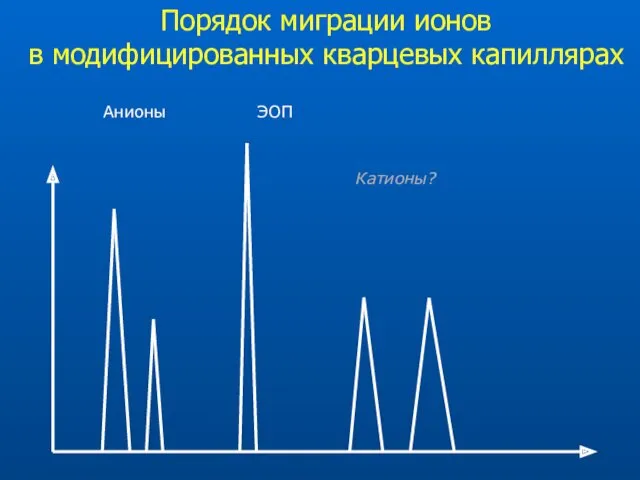
- 30. Порядок миграции ионов в модифицированных кварцевых капиллярах
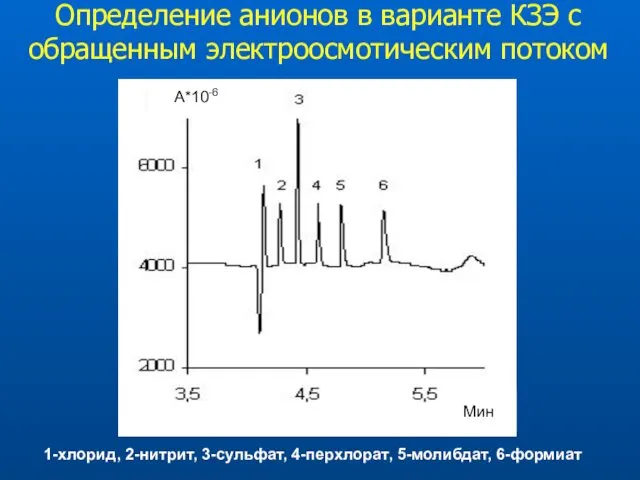
- 31. Определение анионов в варианте КЗЭ с обращенным электроосмотическим потоком 1-хлорид, 2-нитрит, 3-сульфат, 4-перхлорат, 5-молибдат, 6-формиат Мин
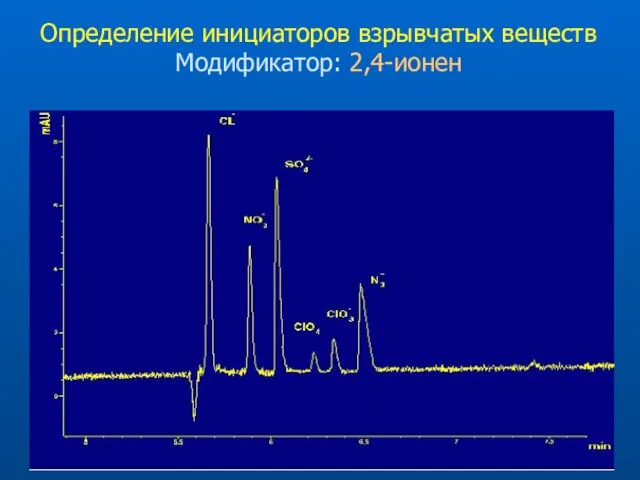
- 32. Определение инициаторов взрывчатых веществ Модификатор: 2,4-ионен
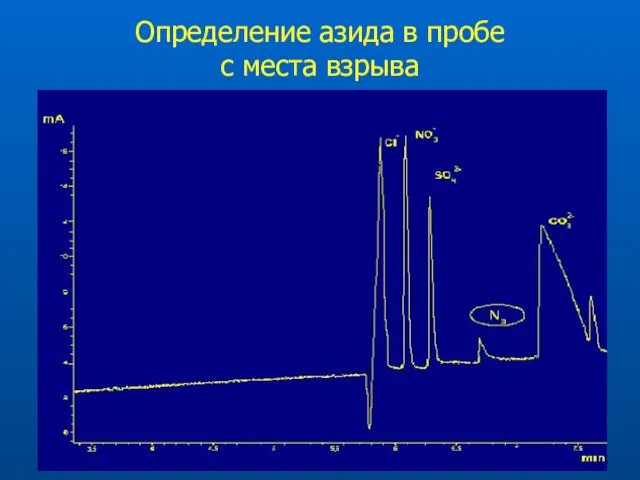
- 33. Определение азида в пробе с места взрыва
- 34. Анализ лекарственных композиций Церебролизин ® Высокое качество Аминокислоты Витамины Ароматические консерванты ПАВ Гетероциклы Гормоны другие вещества
- 35. Структура 2,10-ионена
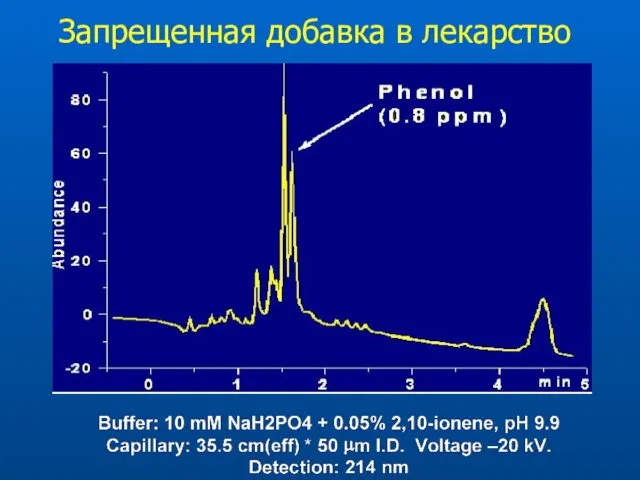
- 36. Запрещенная добавка в лекарство
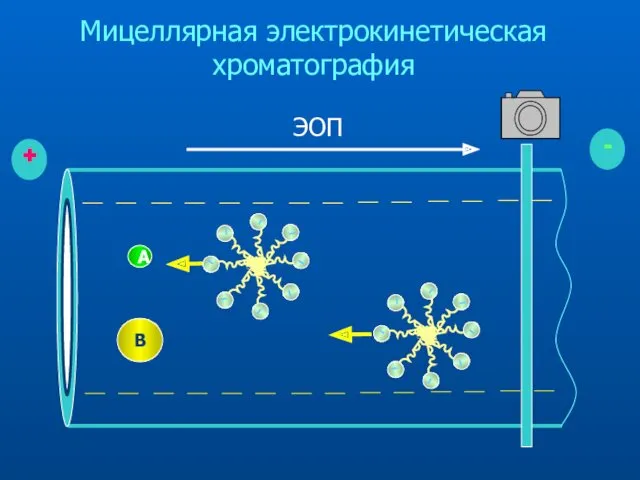
- 37. Мицеллярная электрокинетическая хроматография
- 38. A B Мицеллярная электрокинетическая хроматография
- 39. Два механизма разделения Электрофоретическая подвижность в свободном растворе электролита Распределение между аналитом и мицеллами Мицеллы Образуются
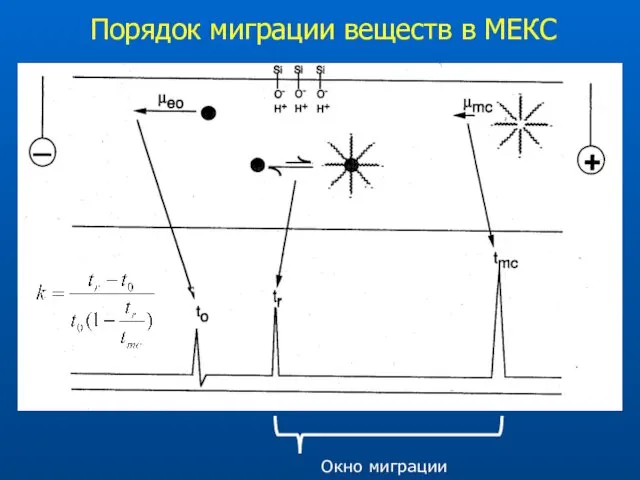
- 40. Порядок миграции веществ в МЕКС
- 41. Факторы, влияющие на селективность в МЕКС Природа ПАВ Длина гидрофобного «хвоста» и природа гидрофильных ионогенных групп
- 42. Хорошие начальные условия для МЕКС: Капилляр: 50 мкм внутренний диаметр, 60 см длина Электролит: 20 мМ
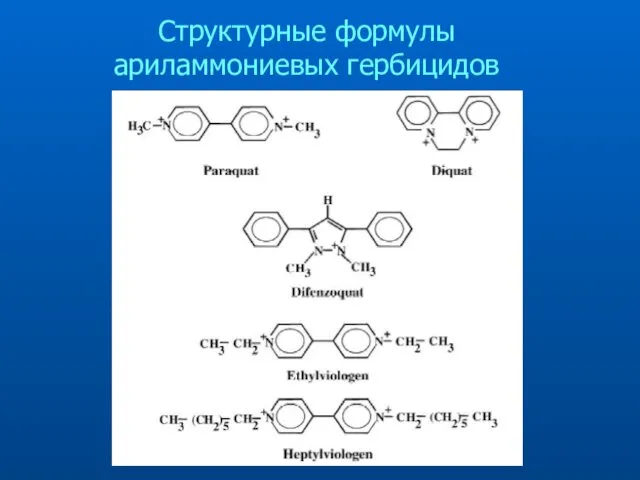
- 43. Структурные формулы ариламмониевых гербицидов
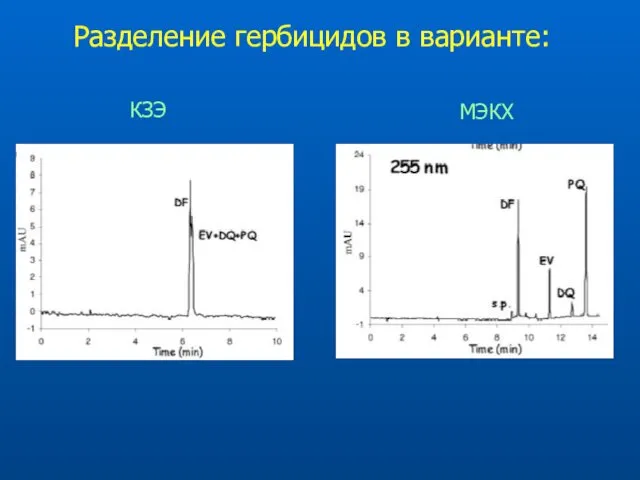
- 44. Разделение гербицидов в варианте: КЗЭ МЭКХ
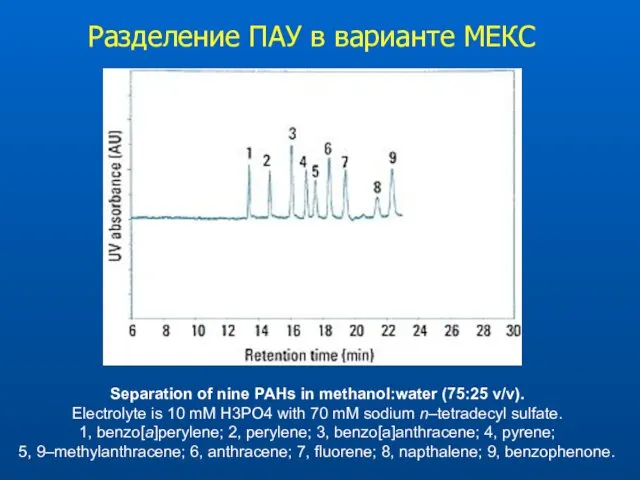
- 45. Separation of nine PAHs in methanol:water (75:25 v/v). Electrolyte is 10 mM H3PO4 with 70 mM
- 46. Разделение смеси хинолинов методом МЕКС с Brij-35 в качестве мицеллообразователя Электролит: 10 мМ Brij-35, ацетат натрия,
- 47. Разделение смеси хинолинов методом МЕКС с SDS в качестве мицеллообразователя Электролит: 50 мМ SDS, 25 мМ
- 48. Строение водорастворимого полиэлектролитного комплекса
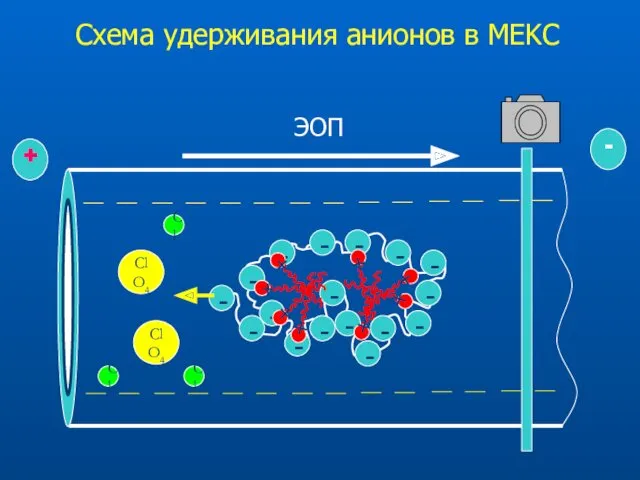
- 49. Схема удерживания анионов в МEKC Cl ClO4 ClO4 Cl Cl
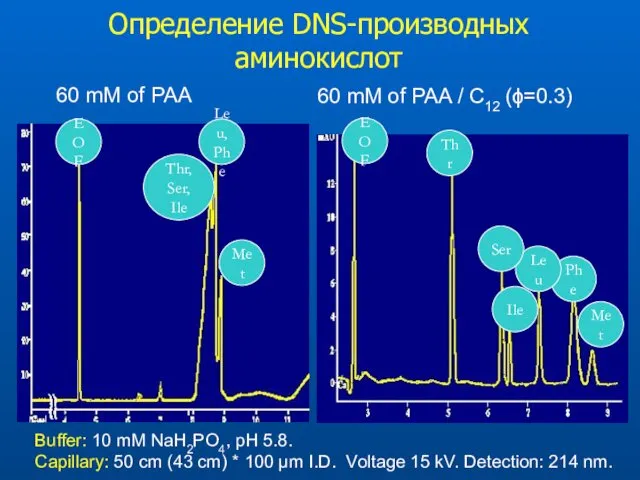
- 50. Определение DNS-производных аминокислот Buffer: 10 mM NaH2PO4, pH 5.8. Capillary: 50 cm (43 cm) * 100
- 51. Микроэмульсионная электрокинетическая хроматография
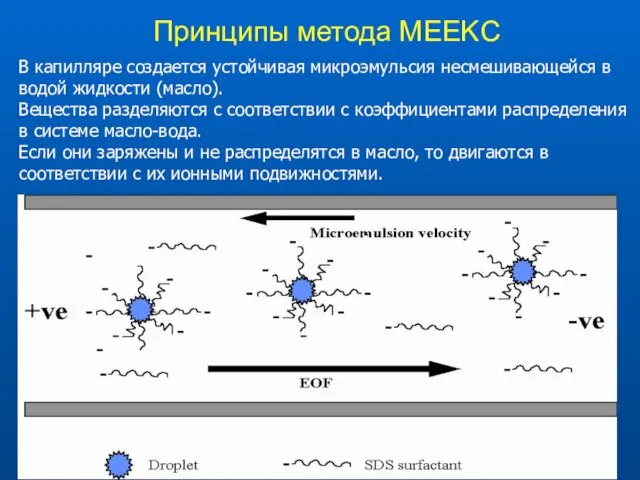
- 52. Принципы метода МEEKC В капилляре создается устойчивая микроэмульсия несмешивающейся в водой жидкости (масло). Вещества разделяются с
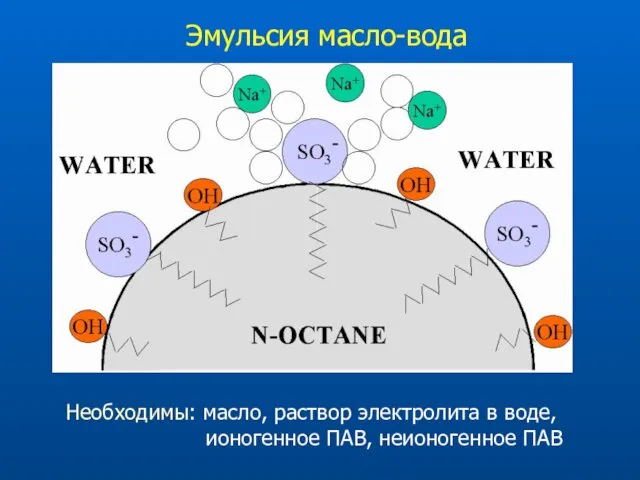
- 53. Эмульсия масло-вода Необходимы: масло, раствор электролита в воде, ионогенное ПАВ, неионогенное ПАВ
- 54. Хорошие начальные условия для МЕЕКС: Капилляр: 50 мкм внутренний диаметр, 60 см длина Электролит: 0.81 g
- 55. Разделение смеси хинолинов методом МЕEКС с Brij-35в качестве ПАВ Электролит: 50 мМ ацетата натрия, рН 4.0
- 56. Разделение смеси хинолинов методом МЕEКС с SDS в качестве ПАВ Электролит: 50 мМ борная кислота, рН
- 57. Капиллярный гель-электрофорез
- 58. Особенности СGE Разделение основано на эксклюзии ЭОП подавлен или изменен Капилляры заполнены полимером Линейный полиакриламид Сшитые
- 59. Механизм CGE Разделяемые вещества движутся по капилляру в зависимости от собственной подвижности и способности проникать в
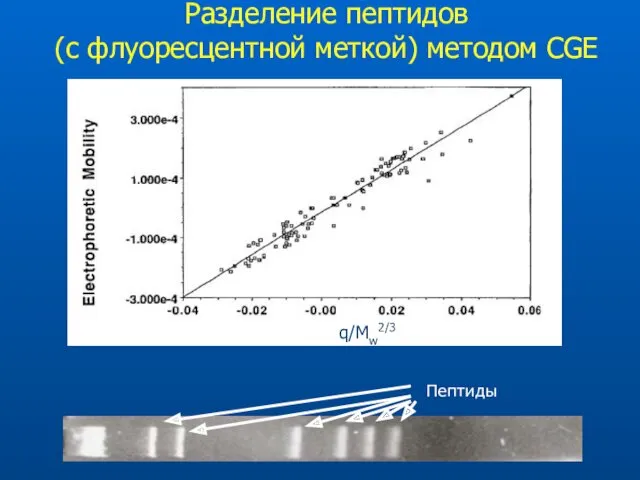
- 60. Разделение пептидов (с флуоресцентной меткой) методом CGE q/Mw2/3 Пептиды
- 61. Капиллярная электрохроматография в заполненных капиллярах
- 62. Принципы метода CЕС CEC является гибридным методом Комбинация КЗЭ и ВЭЖХ Электрофоретическое движение подвижной фазы Неподвижные
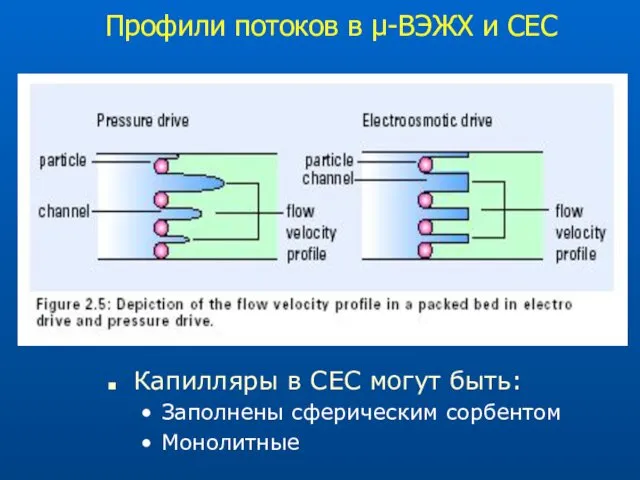
- 63. Профили потоков в μ-ВЭЖХ и CЕС Капилляры в СЕС могут быть: Заполнены сферическим сорбентом Монолитные
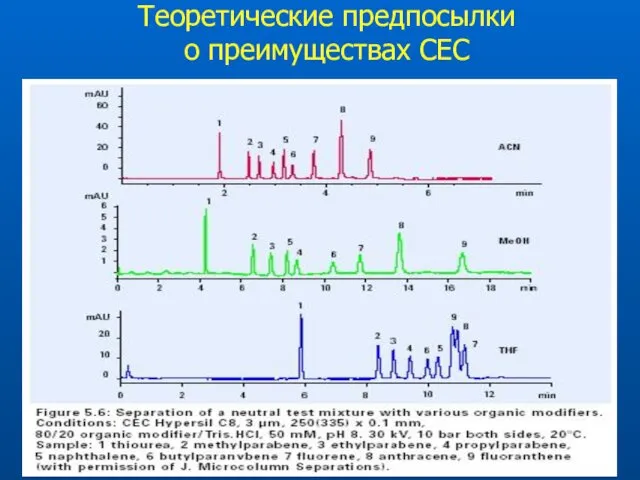
- 64. Теоретические предпосылки о преимуществах СЕС Плоский профиль потока подвижной фазы Размер частиц сорбента Нет ограничений по
- 65. Теоретические предпосылки о преимуществах СЕС
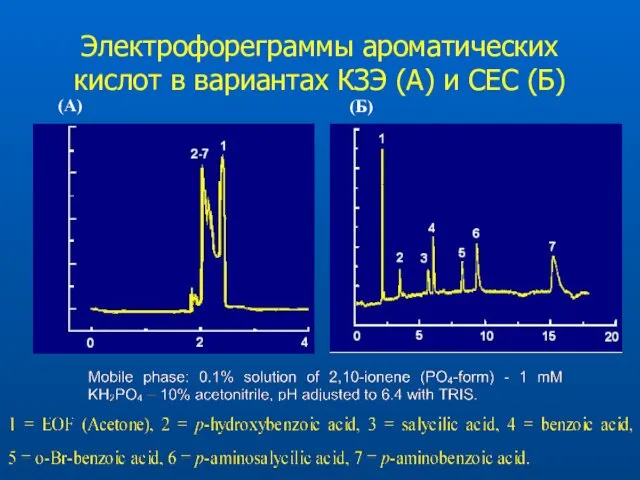
- 66. Электрофореграммы ароматических кислот в вариантах КЗЭ (A) и СЕС (Б) (A) (Б)
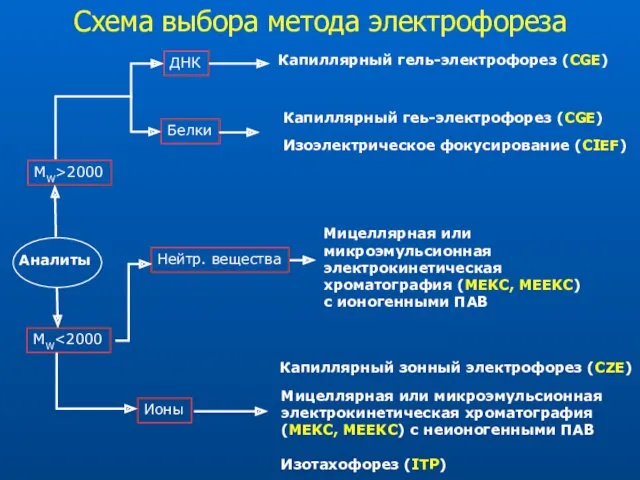
- 67. Аналиты MW>2000 MW Капиллярный гель-электрофорез (CGE) Ионы Нейтр. вещества Мицеллярная или микроэмульсионная электрокинетическая хроматография (MEKC, MEEKC)
- 68. Электрофорез на микрочипе
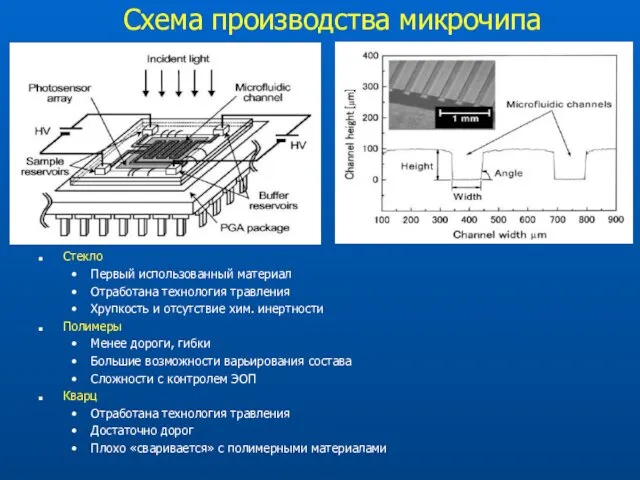
- 69. Схема производства микрочипа Стекло Первый использованный материал Отработана технология травления Хрупкость и отсутствие хим. инертности Полимеры
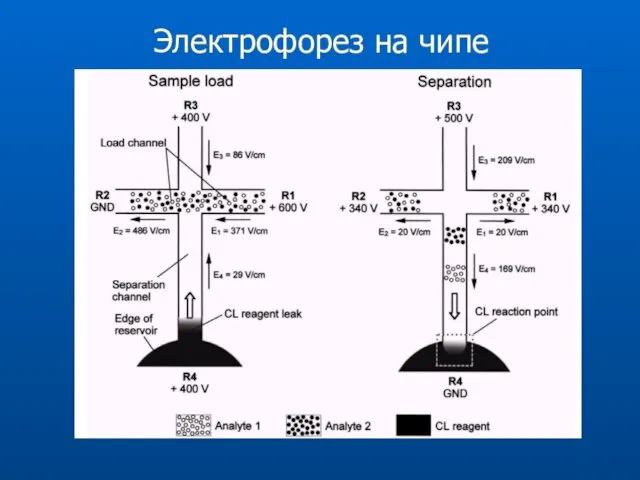
- 70. Электрофорез на чипе
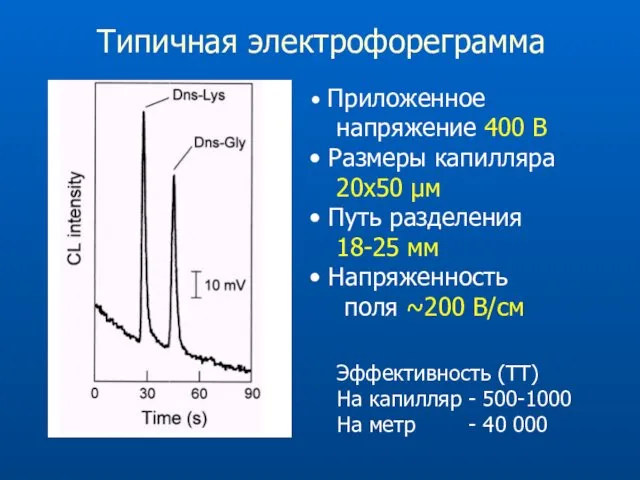
- 71. Типичная электрофореграмма Приложенное напряжение 400 В Размеры капилляра 20х50 μм Путь разделения 18-25 мм Напряженность поля
- 72. Типичная структура капилляра «песочные часы» Длина пути «до разделения» 9μм Напряженность поля 100 кВ/см Скорость переноса
- 73. Устройство для оттягивания микропипеток Контролируются Температура Скорость нагрева Зона нагрева Величина растягивания Получаемый диаметр (до 0.1
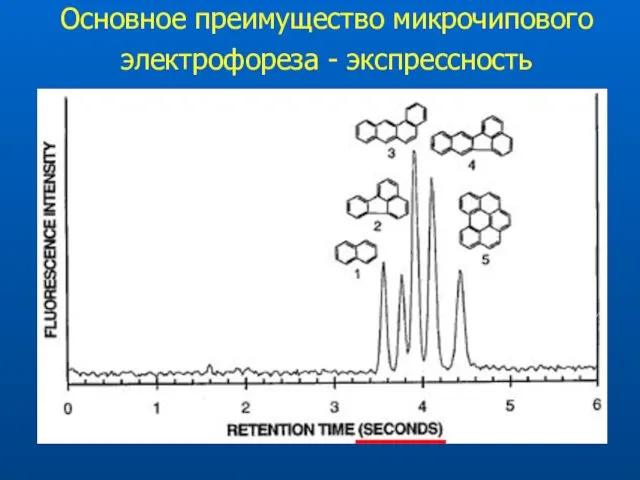
- 74. Основное преимущество микрочипового электрофореза - экспрессность
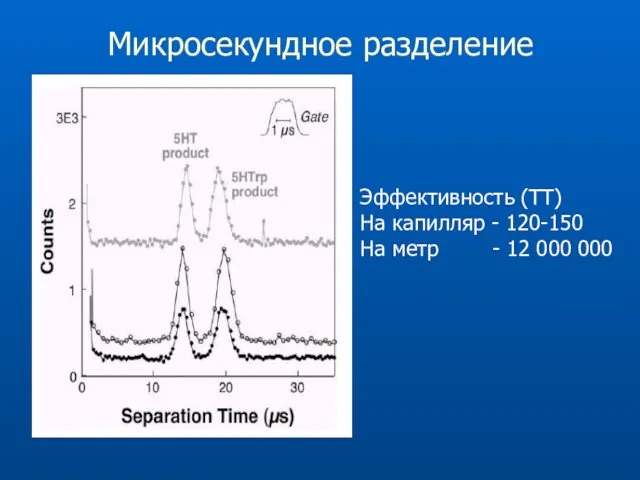
- 75. Микросекундное разделение Эффективность (ТТ) На капилляр - 120-150 На метр - 12 000 000
- 77. Приборы для капиллярного электрофореза
- 78. Agilent 3D
- 80. Скачать презентацию







































 Молодежный научно-образовательный форум RE:ПОСТ (патриотизм, образование, студенчество)
Молодежный научно-образовательный форум RE:ПОСТ (патриотизм, образование, студенчество) Graphic Card Performance SPECViewperf 13
Graphic Card Performance SPECViewperf 13 Презентация Номенклатура Африки
Презентация Номенклатура Африки Принципы организации развивающей предметно-пространственной среды в группах детского сада в соответствии с Федеральным государственным образовательным стандартом дошкольных организаций.
Принципы организации развивающей предметно-пространственной среды в группах детского сада в соответствии с Федеральным государственным образовательным стандартом дошкольных организаций. Разница между британской и американской грамматикой
Разница между британской и американской грамматикой Жизнь на разных материках. 5 класс
Жизнь на разных материках. 5 класс Презентация Загадки о профессиях
Презентация Загадки о профессиях Использование мяча на этапе автоматизации звуков.
Использование мяча на этапе автоматизации звуков. Игра Колесо истории
Игра Колесо истории КВ и УКВ радиосвязь
КВ и УКВ радиосвязь Технологии продвижения на рынке СМИ
Технологии продвижения на рынке СМИ практическая работа №2 по биологии
практическая работа №2 по биологии Половое воспитание младших школьников.
Половое воспитание младших школьников. Трудовые ресурсы и экономически активное население. Неравномерность в распределении. Изменение структуры занятости населения
Трудовые ресурсы и экономически активное население. Неравномерность в распределении. Изменение структуры занятости населения Сказка Дюймовочка
Сказка Дюймовочка Водород и его изотопы
Водород и его изотопы Goniometric study of crystals
Goniometric study of crystals презентация 2022 для Дня открытых дверей
презентация 2022 для Дня открытых дверей как подготовить ребенка к школе
как подготовить ребенка к школе Методы очистки и разделения веществ
Методы очистки и разделения веществ Краткое содержание Слово о полку Игореве
Краткое содержание Слово о полку Игореве Чудо - дерево. Сказки и оформление детей подготовительной группы № 9
Чудо - дерево. Сказки и оформление детей подготовительной группы № 9 Netflix. Анализ бренда
Netflix. Анализ бренда Резание (резка) стали
Резание (резка) стали Тип Инфузории. 7 класс
Тип Инфузории. 7 класс Аппликация Барашек.
Аппликация Барашек. Email about personal information
Email about personal information формирование исследовательских навыков на уроках биологии
формирование исследовательских навыков на уроках биологии