Содержание
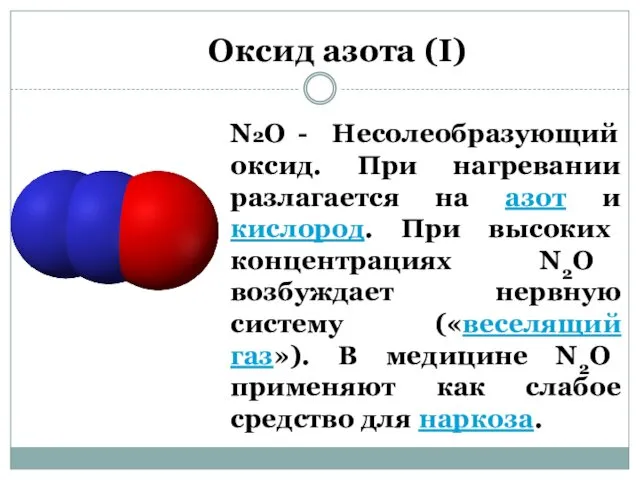
- 2. N2O - Несолеобразующий оксид. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает
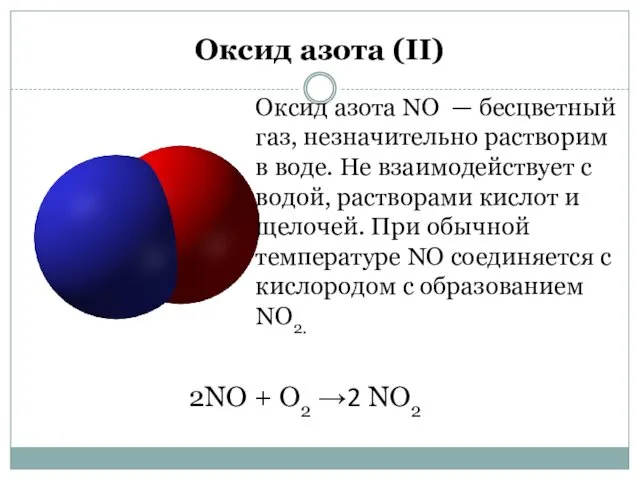
- 3. Оксид азота (II) Оксид азота NO — бесцветный газ, незначительно растворим в воде. Не взаимодействует с
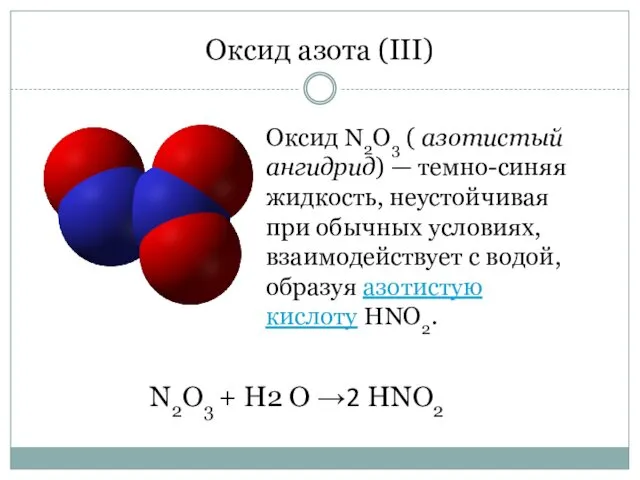
- 4. Оксид азота (III) Оксид N2O3 ( азотистый ангидрид) — темно-синяя жидкость, неустойчивая при обычных условиях, взаимодействует
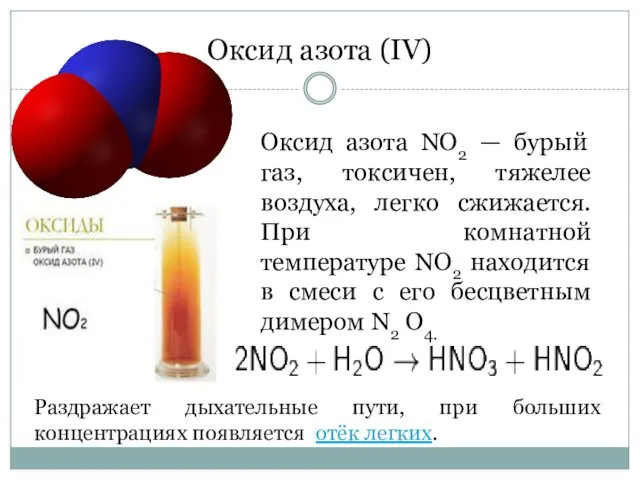
- 5. Оксид азота (IV) Оксид азота NO2 — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной
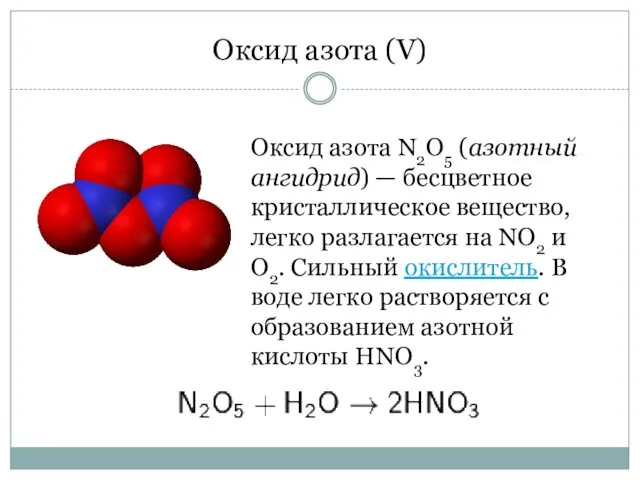
- 6. Оксид азота (V) Оксид азота N2O5 (азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NO2
- 7. Азотная кислота Чистая азотная кислота HNO3 —бесцветная жидкость На воздухе она «дымит», так как пары ее
- 9. Скачать презентацию

 Молодежный научно-образовательный форум RE:ПОСТ (патриотизм, образование, студенчество)
Молодежный научно-образовательный форум RE:ПОСТ (патриотизм, образование, студенчество) Graphic Card Performance SPECViewperf 13
Graphic Card Performance SPECViewperf 13 Презентация Номенклатура Африки
Презентация Номенклатура Африки Принципы организации развивающей предметно-пространственной среды в группах детского сада в соответствии с Федеральным государственным образовательным стандартом дошкольных организаций.
Принципы организации развивающей предметно-пространственной среды в группах детского сада в соответствии с Федеральным государственным образовательным стандартом дошкольных организаций. Разница между британской и американской грамматикой
Разница между британской и американской грамматикой Жизнь на разных материках. 5 класс
Жизнь на разных материках. 5 класс Презентация Загадки о профессиях
Презентация Загадки о профессиях Использование мяча на этапе автоматизации звуков.
Использование мяча на этапе автоматизации звуков. Игра Колесо истории
Игра Колесо истории КВ и УКВ радиосвязь
КВ и УКВ радиосвязь Технологии продвижения на рынке СМИ
Технологии продвижения на рынке СМИ практическая работа №2 по биологии
практическая работа №2 по биологии Половое воспитание младших школьников.
Половое воспитание младших школьников. Трудовые ресурсы и экономически активное население. Неравномерность в распределении. Изменение структуры занятости населения
Трудовые ресурсы и экономически активное население. Неравномерность в распределении. Изменение структуры занятости населения Сказка Дюймовочка
Сказка Дюймовочка Водород и его изотопы
Водород и его изотопы Goniometric study of crystals
Goniometric study of crystals презентация 2022 для Дня открытых дверей
презентация 2022 для Дня открытых дверей как подготовить ребенка к школе
как подготовить ребенка к школе Методы очистки и разделения веществ
Методы очистки и разделения веществ Краткое содержание Слово о полку Игореве
Краткое содержание Слово о полку Игореве Чудо - дерево. Сказки и оформление детей подготовительной группы № 9
Чудо - дерево. Сказки и оформление детей подготовительной группы № 9 Netflix. Анализ бренда
Netflix. Анализ бренда Резание (резка) стали
Резание (резка) стали Тип Инфузории. 7 класс
Тип Инфузории. 7 класс Аппликация Барашек.
Аппликация Барашек. Email about personal information
Email about personal information формирование исследовательских навыков на уроках биологии
формирование исследовательских навыков на уроках биологии