Содержание
- 2. ЛЕКЦИЯ № 3 КЛИНИЧЕСКАЯ ЭНЗИМОЛОГИЯ, или ИСПОЛЬЗОВАНИЕ ФЕРМЕНТОВ В МЕДИЦИНЕ
- 3. Актуальность темы Широкое использование ферментов в медицинской практике – диагностике и терапии, - диктует необходимость изучения
- 4. План лекции Применение ферментов как реагентов в диагностике заболеваний Применение ферментов в качестве лекарственных препаратов (энзимотерапия)
- 5. Цель лекции Знать: пути использования ферментов в медицинской практике (примеры) ферменты, используемые в энзимодиагностике, и сущность
- 6. Ферменты как реагенты ПРИМЕРЫ: Глюкозооксидаза грибов (аэробная дегидрогеназа ) – FAD-содержащий специфический фермент для определения глюкозы
- 7. Ферменты как реагенты Определение лактата в крови для оценки тяжести шока, гипоксических состояний, сахарного диабета с
- 8. Ферменты как реагенты Рестриктазы бактерий (специфические эндонуклеазы) используются для исследования генома, например, в пренатальном скрининге наследственных
- 9. Энзимотерапия Применение ферментов (гидролазы) в качестве лекарственных препаратов Заместительная терапия – использование ферментов в случае их
- 10. Энзимотерапия Комплексная терапия – применение ферментов в качестве дополнительного терапевтического средства ПРИМЕРЫ: фитогидролазы: бромелаин, папаин (широкая
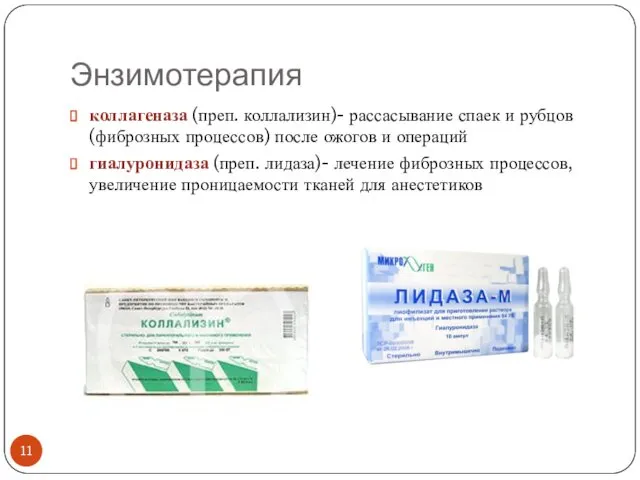
- 11. Энзимотерапия коллагеназа (преп. коллализин)- рассасывание спаек и рубцов (фиброзных процессов) после ожогов и операций гиалуронидаза (преп.
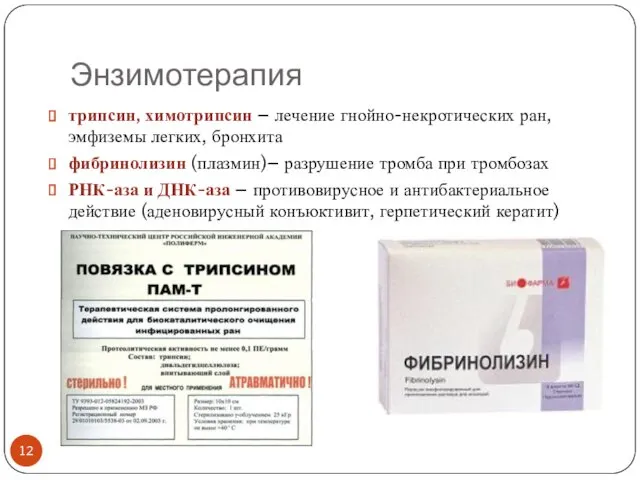
- 12. Энзимотерапия трипсин, химотрипсин – лечение гнойно-некротических ран, эмфиземы легких, бронхита фибринолизин (плазмин)– разрушение тромба при тромбозах
- 13. Энзимотерапия аспарагиназа, глутаминаза – лечение лейкозов Лейкозные клетки не способны синтезировать асн и глн – аминокислоты,
- 14. Трудности энзимотерапии нестабильность ферментов антигенные свойства трудности доставки к пораженным органам ПРИМЕР: действие фибринолизина не является
- 15. Иммобилизованные ферменты Иммобилизация (лат. immobilis – неподвижный) – связывание молекул ферментов с носителем Преимущества: устойчивость, нерастворимость
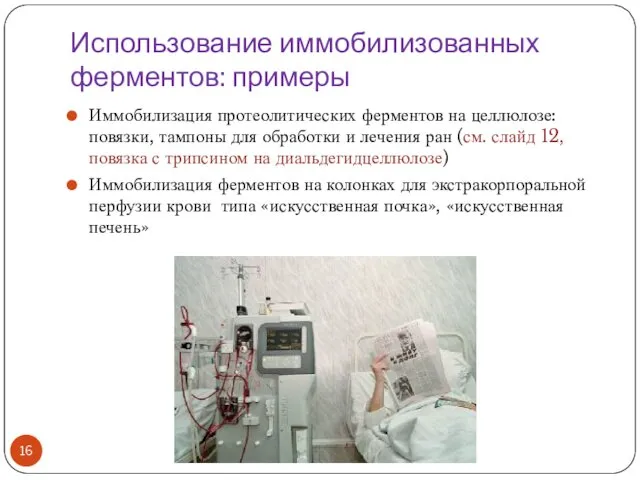
- 16. Использование иммобилизованных ферментов: примеры Иммобилизация протеолитических ферментов на целлюлозе: повязки, тампоны для обработки и лечения ран
- 17. Энзимодиагностика Постановка диагноза на основе определения активности ферментов в биологических жидкостях человека Используются ферменты, которые по
- 18. Секреторные ферменты синтезируются в печени «работают» в крови (субстрат фермента находится в крови) активность в крови
- 19. Экскреторные ферменты синтезируются в экзокринных железах «работают» в полости органов активность в крови незначительная и обусловлена
- 20. Внутриклеточные ферменты: цитоплазматические: лактатдегидрогеназа (ЛДГ), аланин (аспартат) аминотрансфераза (АЛТ, АСТ), креатинкиназа (КК) митохондриальные: АСТ лизосомные: кислая
- 21. «Требования» к ферментам энзимодиагностики Органоспецифичность (тканеспецифичность) фермента или его изоформ: преимущественная или абсолютная локализация в определенных
- 22. Изоферменты Множественные формы одного олигомерного фермента (имеющего IV структуру), обусловленные различными комбинациями разных по структуре субъединиц
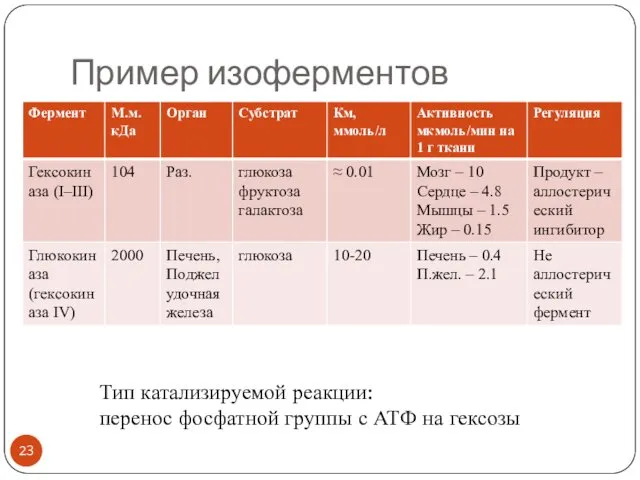
- 23. Пример изоферментов Тип катализируемой реакции: перенос фосфатной группы с АТФ на гексозы
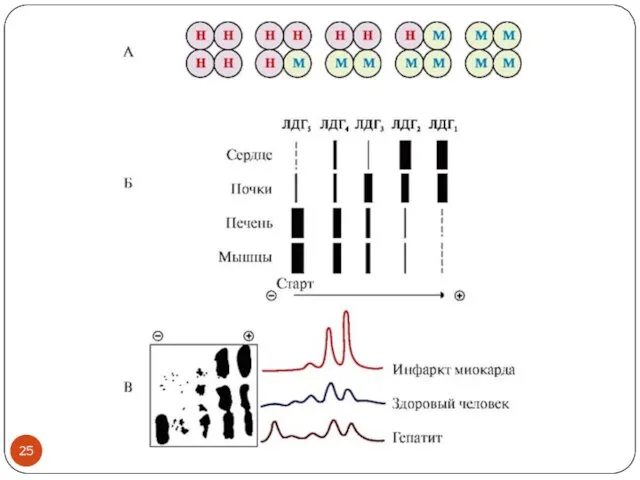
- 24. Изоформы в диагностике заболеваний Лактатдегидрогеназа (ЛДГ) пируват + NADH+Н+ ↔ лактат + NAD+ Охарактеризуйте положение фермента
- 26. Лактатдегидрогеназа 1 и 2 – сердечные изоформы Специфичность ЛДГ 1 и 2 выше к лактату, чем
- 27. Изоформы в диагностике заболеваний Креатинкиназа (КК) креатин + АТФ ↔ креатинфосфат + АДФ Охарактеризуйте положение фермента
- 28. КК-ММ (скелетная мышца) – диагностика повреждений скелетных мышц КК-МВ (сердечная мышца) – диагностика инфаркта миокарда КК-ВВ
- 29. Почему важно определять изоферментный состав, а не просто суммарную активность фермента? Суммарная активность фермента не предоставляет
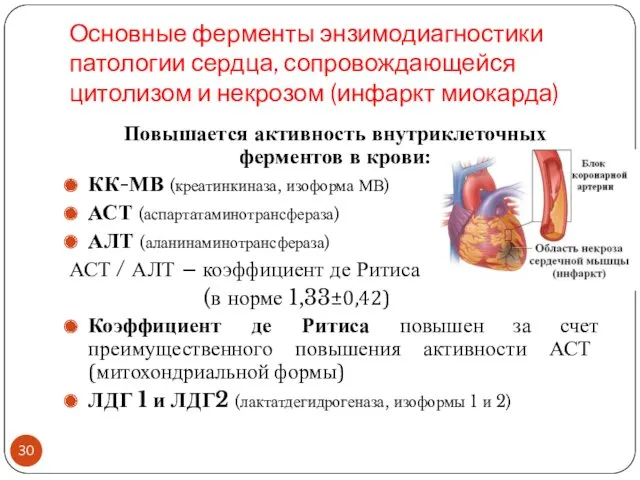
- 30. Основные ферменты энзимодиагностики патологии сердца, сопровождающейся цитолизом и некрозом (инфаркт миокарда) Повышается активность внутриклеточных ферментов в
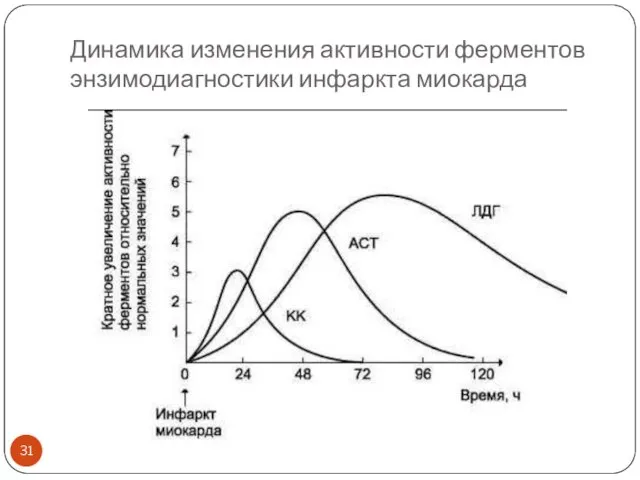
- 31. Динамика изменения активности ферментов энзимодиагностики инфаркта миокарда
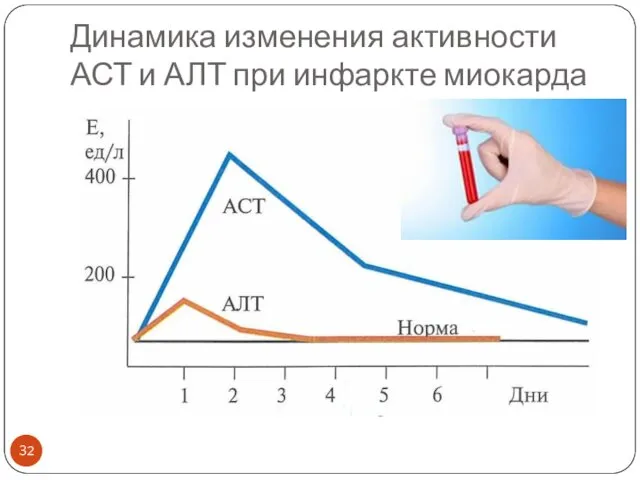
- 32. Динамика изменения активности АСТ и АЛТ при инфаркте миокарда
- 33. Основные ферменты энзимодиагностики патологии печени Воспаление, цитолиз, некроз (гепатит, цирроз) Повышается активность внутриклеточных ферментов в крови:
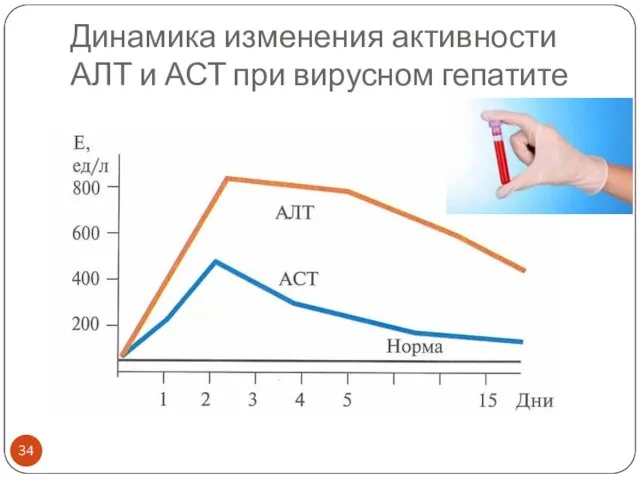
- 34. Динамика изменения активности АЛТ и АСТ при вирусном гепатите
- 35. Основные ферменты энзимодиагностики патологии печени Синдром холестаза Повышается активность экскреторного фермента печени в крови – ЩФ
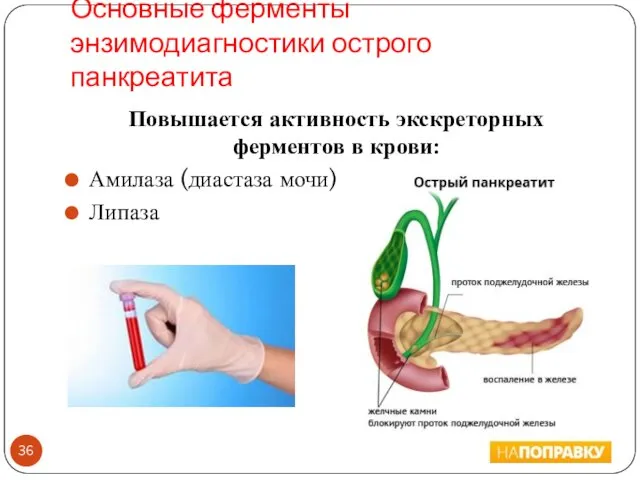
- 36. Основные ферменты энзимодиагностики острого панкреатита Повышается активность экскреторных ферментов в крови: Амилаза (диастаза мочи) Липаза
- 37. Дополнительные вопросы клинической энзимологии Использование ингибиторов ферментов в качестве лекарственных препаратов Энзимопатии
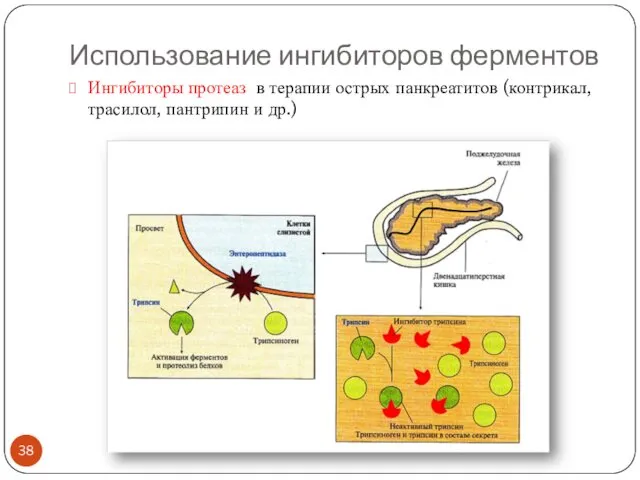
- 38. Использование ингибиторов ферментов Ингибиторы протеаз в терапии острых панкреатитов (контрикал, трасилол, пантрипин и др.)
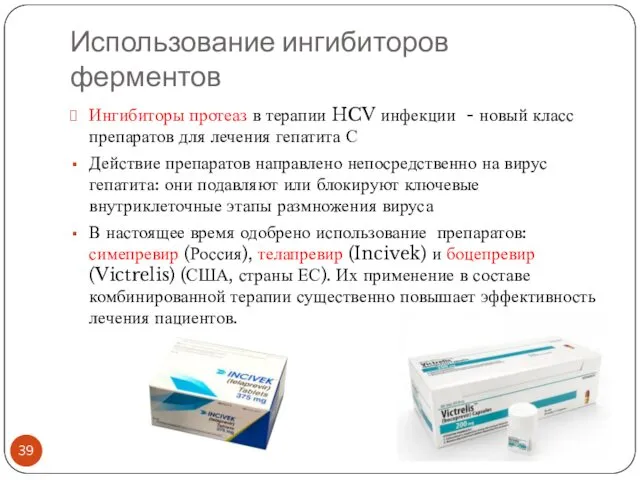
- 39. Использование ингибиторов ферментов Ингибиторы протеаз в терапии HCV инфекции - новый класс препаратов для лечения гепатита
- 40. Использование ингибиторов ферментов Ингибиторы ангиотензин-превращающего фермента – лечение гипертонии (берлиприл, вазолонг и др.) Ингибиторы ксантиноксидазы –
- 41. Энзимопатии Патологические процессы, основанные на нарушении ферментативного катализа по причине мутации генов ферментов или нарушения экспрессии
- 42. Задание № 1 для самостоятельной работы В современной клинической лабораторной диагностике широко используется метод иммуноферментного анализа
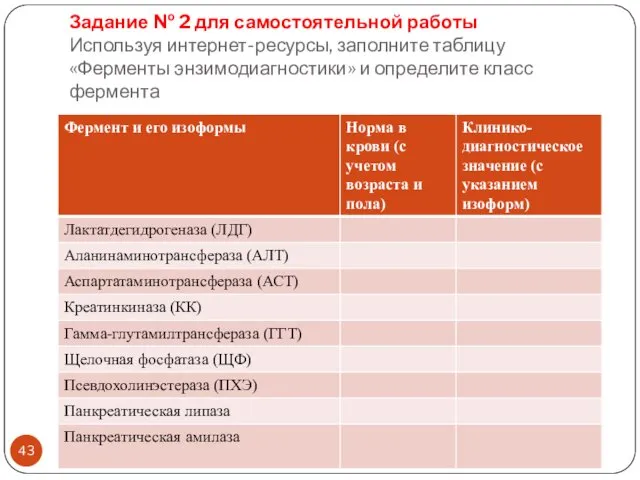
- 43. Задание № 2 для самостоятельной работы Используя интернет-ресурсы, заполните таблицу «Ферменты энзимодиагностики» и определите класс фермента
- 44. ВОПРОСЫ ДЛЯ РАЗМЫШЛЕНИЯ Почему активность аминотрансфераз у детей раннего возраста выше, чем у взрослых? Почему активность
- 45. Заключение Ферменты используются в диагностике заболеваний как специфические реагенты Препараты ферментов используются в заместительной и комплексной
- 47. Скачать презентацию































 Антиагреганты. Применение в реальной клинической практике
Антиагреганты. Применение в реальной клинической практике WLS Definitions Training. Machine terminology, bucket sizing and selection
WLS Definitions Training. Machine terminology, bucket sizing and selection Презентация к внеклассному мероприятию Моя родина - Россия
Презентация к внеклассному мероприятию Моя родина - Россия Инновационные технологии для повышения эффективности работы Оперативно-диспетчерского Подразделения
Инновационные технологии для повышения эффективности работы Оперативно-диспетчерского Подразделения Огонь - наш друг и враг
Огонь - наш друг и враг Нарушение синтаксических норм. ЕГЭ. Задание 8
Нарушение синтаксических норм. ЕГЭ. Задание 8 Жизнь нашей группы – интересное и полезное путешествие
Жизнь нашей группы – интересное и полезное путешествие Блюхер Василий Константинович (1890-1938)
Блюхер Василий Константинович (1890-1938) Методология экономического анализа. Тема 2
Методология экономического анализа. Тема 2 Паровая и газовая турбины
Паровая и газовая турбины Холодные блюда и закуски. Бутерброды
Холодные блюда и закуски. Бутерброды Выпуск 2013 Диск
Выпуск 2013 Диск Горькая правда о чипсах ( презентация к занятию)
Горькая правда о чипсах ( презентация к занятию) Заболевания свиней
Заболевания свиней Теорема Эйлера и правильные многогранники. 10 класс
Теорема Эйлера и правильные многогранники. 10 класс Hatching, Cross-Hatching and Stippling
Hatching, Cross-Hatching and Stippling НОД Познание -Писатели детям
НОД Познание -Писатели детям Правила безопасного поведения зимой
Правила безопасного поведения зимой Кодирование информации, 8 класс
Кодирование информации, 8 класс Основной капитал предприятия
Основной капитал предприятия Презентация к родительскому собранию на тему Наши трудные дети
Презентация к родительскому собранию на тему Наши трудные дети Автоматизация звука Л словах и словосочетаниях
Автоматизация звука Л словах и словосочетаниях Описание филимоновской игрушки (Русский язык 5 класс)
Описание филимоновской игрушки (Русский язык 5 класс) Случаи сложения вида +7
Случаи сложения вида +7 Service-oriented architecture (SOA) - сервис-ориентированная архитектура
Service-oriented architecture (SOA) - сервис-ориентированная архитектура Дидактическая игра на сравнение - 7. Вверху-внизу, слева-справа
Дидактическая игра на сравнение - 7. Вверху-внизу, слева-справа Примерная программа формирования культуры здорового и безопасного образа жизни.
Примерная программа формирования культуры здорового и безопасного образа жизни. Создание иллюстрации Роспись шкатулки
Создание иллюстрации Роспись шкатулки