Содержание
- 2. Современная координационная химия связана с именем швейцарского химика А. Вернера, сформулировавшего основные положения координационной теории (1893
- 3. ВЕРНЕР АЛЬФРЕД (12.XII.1866–15.XI.1919) Швейцарский химик. Основоположник химии комплексных (координационных) соединений. Выдвинул и развил (1893) координационную теорию
- 4. Комплексными называют соединения, содержащие в одном из агрегатных состояний группу ионов или нейтральных молекул (лигандов), в
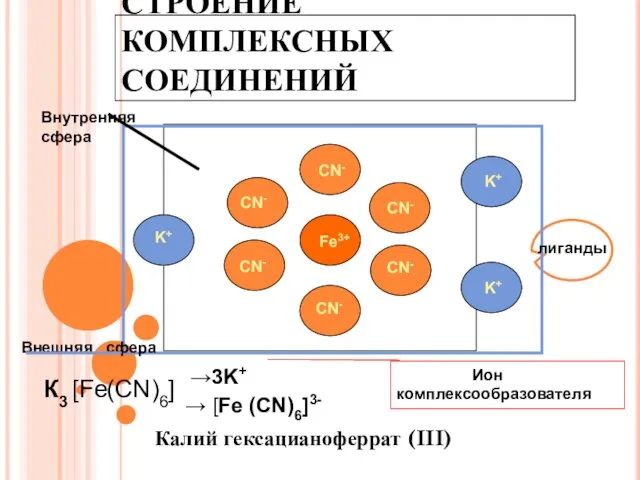
- 6. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Калий гексацианоферрат (III) Fe3+ CN- CN- CN- CN- CN- CN- K+ K+ K+
- 7. Центральный атом Лиганды К4[Fe(CN)6] Внешняя сфера Внутренняя сфера Координационное число
- 8. Формула комплексного иона или молекулы записывается, как правило, слева направо в следующей последовательности: центральный атом (ион),
- 9. Система комплексообразователь–лиганды называется внутренней координационной сферой, обычно отделяемой квадратными скобками от внешней координационной сферы: K4[Fe(CN)6], [Cr(NH3)6]Cl3,
- 10. В комплексных ионах [Cu(NH3)4]2+, [SiF6]2- , [Fe(CN)6]4- , [BF4]- комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III). Чаще
- 11. ЛИГАНДЫ Лигандами могут быть различные неорганические и органические ионы и молекулы. Важнейшими лигандами являются ионы CN-,
- 12. Координационным числом называют число атомов лигандов, непосредственно присоединенных к центральному атому. Лиганды характеризуются дентатностью (от английского
- 14. НОМЕНКЛАТУРА
- 15. Классификация комплексных соединений По заряду комплекса Катионные комплексы [Zn(NH3)4]Cl2 [Co(NH3)6]Cl2 Анионные комплексы K2[BeF4] Li[AlH4] Нейтральные комплексы
- 16. Номенклатура 1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть
- 17. 3) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами
- 18. Название комплексного соединения электролита начинается с аниона, употребляемого в именительном падеже, затем следует название катиона в
- 21. K2[CuCl4] [Cr(H2O)6]Cl3 [Co(NO2)2(NH3)4]Cl [PtCl4(H2O)2] [Cr(NH3)6][Fe(CN)6] K3[AlF6] К3[Fe(CN)6] K4[Fe(CN)6] [CoN3(NH3)5]SO4
- 22. Na3[Ag(S2O3)2] [Ru(HSO3)2(NH3)4] [CrCl2(NH3)4]Cl K4[Ni(CN)4] [Cu(NH3)2]OH [Co(H2O)6]Cl2 K[AgF4] K[Au(OH)4] K2[Cr(CN)2O2(O2)NH3]
- 23. НАПИШИТЕ ФОРМУЛЫ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ: Дицианоаргентат калия Гексанитрокобальтат (III) калия Хлорид гексаамминникеля (II) Гексацианохромат (III) натрия Бромид
- 24. ВИДЫ Комплексные соединения бывают катионные [Cr(NH3)]Cl3, анионные K4[Fe(CN)6], катион-анионные [Cr(NH3)6] [Fe(CN)6] и нейтральные [PtCl2(NH3)2].
- 25. Положения метода валентных связей 1. В комплексе связь между комплексообразователем и лигандами координационная (ковалентная, донорно- акцепторная).
- 29. КВАДРАТНЫЙ КОМПЛЕКС [PT(NH3)2CL2]
- 30. ОКТАЭДРИЧЕСКИЙ КОМПЛЕКСНЫЙ ИОН [COF6]3-
- 31. диамагнитен
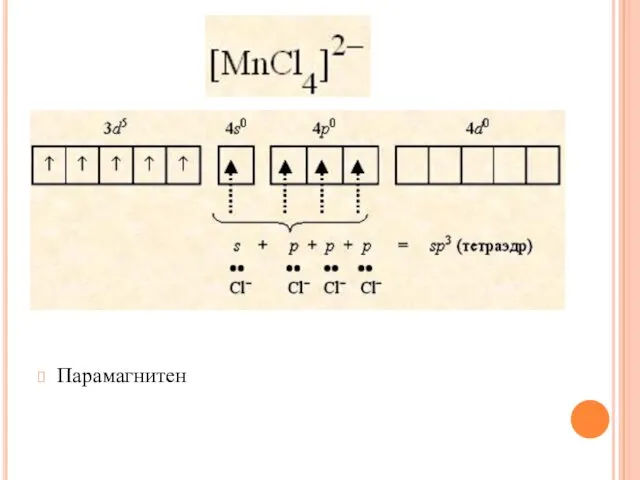
- 32. Парамагнитен
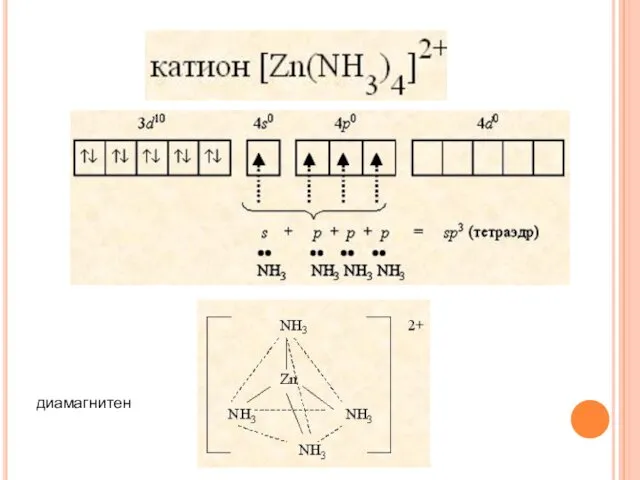
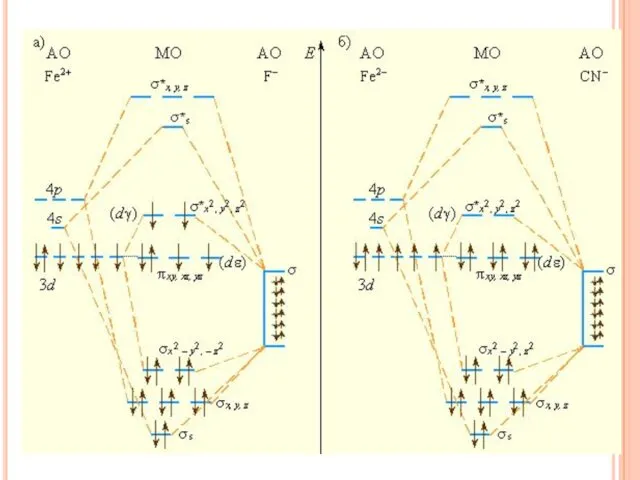
- 33. ХИМИЧЕСКАЯ СВЯЗЬ В КООРДИНАЦИОННЫХ СОЕДИНЕНИЯХ Образование парамагнитного иона [FeF6]4–
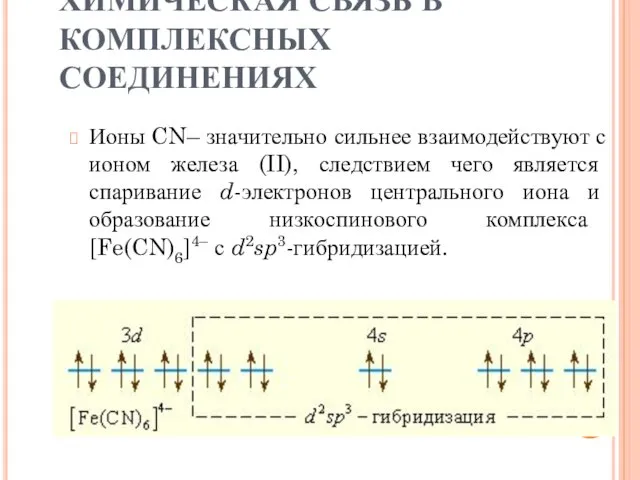
- 34. ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ Ионы CN– значительно сильнее взаимодействуют с ионом железа (II), следствием чего
- 37. ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Гидратная (сольватная) изомерия обусловлена различным расположением молекул воды и анионных лигандов между внутренней
- 38. ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Ионизационная изомерия характеризуется различным распределением ионов между внешними и внутренними сферами комплексных соединений
- 39. ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Координационная изомерия заключается в различном распределении лигандов во внутренних координационных сферах. По-разному взаимодействуют
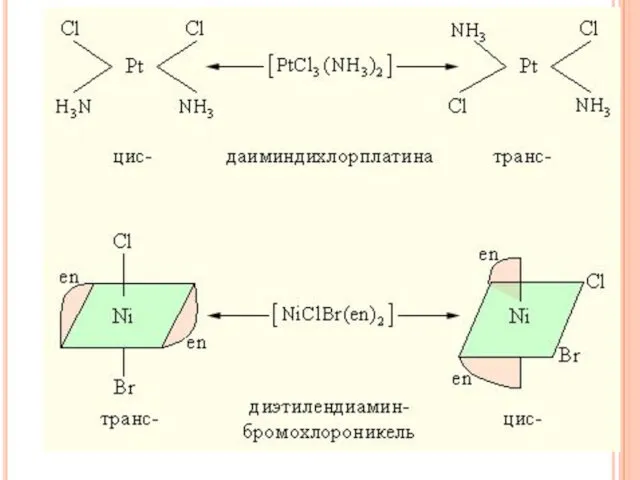
- 40. ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Геометрическая изомерия (цис-транс изомерия) состоит в различном пространственном расположении лигандов вокруг центрального атома.
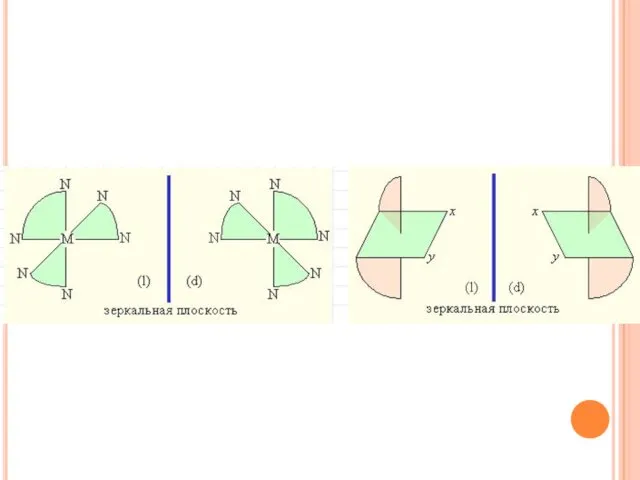
- 42. ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Оптическая изомерия. Оптическая изомерия характеризуется способностью вращать плоскость поляризации плоскополяризованного света. Два изомера
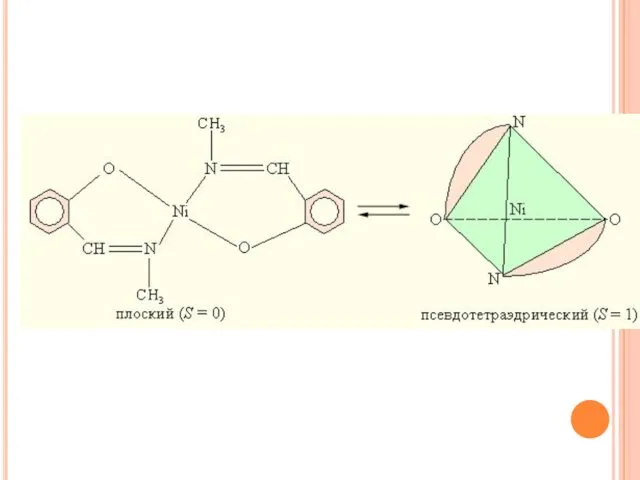
- 44. ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Структурная изомерия. Структурными называют такие координационные изомеры, в которых происходит изменение симметрии (стереохимии)
- 46. УСТОЙЧИВОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ В РАСТВОРАХ Химические свойства комплексного иона с известной электронной конфигурацией и геометрическим строением
- 48. K3[Fe(CN)6] ↔ K+ + [Fe(CN)6]3- [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- Диссоциация КС по внешней сфере (первичная диссоциация)
- 49. [Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)2]+ Ag+ + 2 NH3 Диссоциация КС по внутренней сфере (вторичная диссоциация)
- 50. ДИССОЦИАЦИЯ КОМПЛЕКСНОГО СОЕДИНЕНИЯ [NI(NH3)4]SO4 В ВОДНОМ РАСТВОРЕ
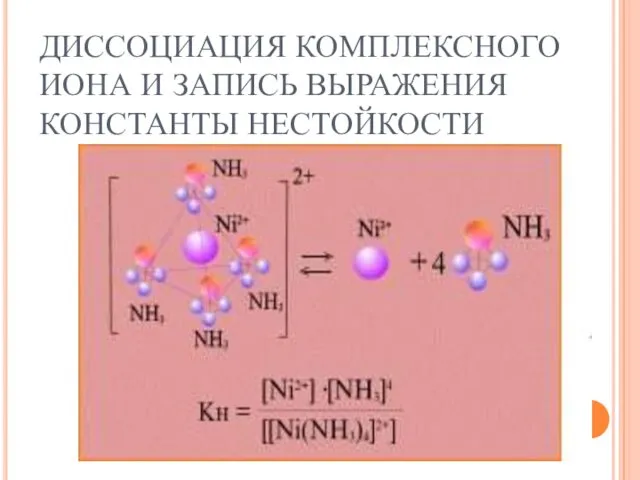
- 51. ДИССОЦИАЦИЯ КОМПЛЕКСНОГО ИОНА И ЗАПИСЬ ВЫРАЖЕНИЯ КОНСТАНТЫ НЕСТОЙКОСТИ
- 52. РЕАКЦИИ С УЧАСТИЕМ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Реакции с участием координационных соединений делятся на четыре основных типа: 1)
- 53. Комплексные ионы участвуют в реакциях обмена с образованием более прочного или менее растворимого соединения: Здесь M
- 54. ПРИСОЕДИНЕНИЕ, ЗАМЕЩЕНИЕ ИЛИ ОТЩЕПЛЕНИЕ ЛИГАНДА 1а. Присоединение лиганда сопровождается изменением степени окисления реагирующих центрального атома и
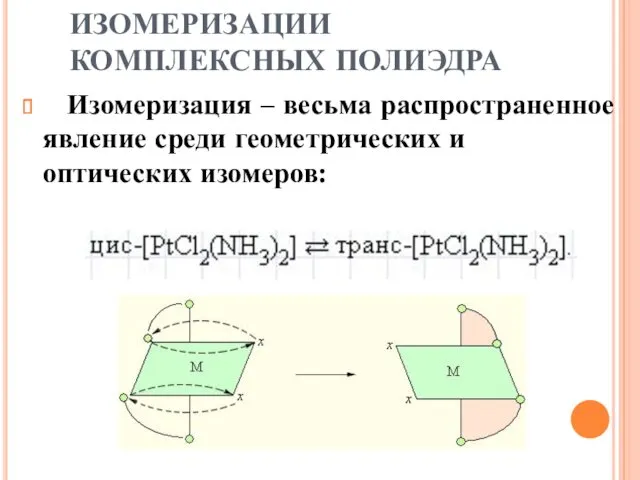
- 55. ИЗОМЕРИЗАЦИИ КОМПЛЕКСНЫХ ПОЛИЭДРА Изомеризация – весьма распространенное явление среди геометрических и оптических изомеров:
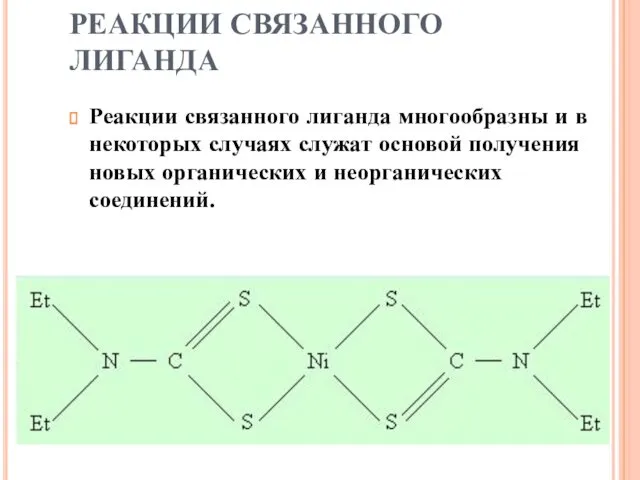
- 56. РЕАКЦИИ СВЯЗАННОГО ЛИГАНДА Реакции связанного лиганда многообразны и в некоторых случаях служат основой получения новых органических
- 57. РЕАКЦИИ ЭЛЕКТРОННОГО ПЕРЕНОСА Реакции электронного переноса сопровождаются изменением степени окисления центрального иона и вызваны образованием более
- 59. Скачать презентацию




![Центральный атом Лиганды К4[Fe(CN)6] Внешняя сфера Внутренняя сфера Координационное число](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-6.jpg)


![В комплексных ионах [Cu(NH3)4]2+, [SiF6]2- , [Fe(CN)6]4- , [BF4]- комплексообразователями](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-9.jpg)



![Классификация комплексных соединений По заряду комплекса Катионные комплексы [Zn(NH3)4]Cl2 [Co(NH3)6]Cl2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-14.jpg)




![K2[CuCl4] [Cr(H2O)6]Cl3 [Co(NO2)2(NH3)4]Cl [PtCl4(H2O)2] [Cr(NH3)6][Fe(CN)6] K3[AlF6] К3[Fe(CN)6] K4[Fe(CN)6] [CoN3(NH3)5]SO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-20.jpg)
![Na3[Ag(S2O3)2] [Ru(HSO3)2(NH3)4] [CrCl2(NH3)4]Cl K4[Ni(CN)4] [Cu(NH3)2]OH [Co(H2O)6]Cl2 K[AgF4] K[Au(OH)4] K2[Cr(CN)2O2(O2)NH3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-21.jpg)

![ВИДЫ Комплексные соединения бывают катионные [Cr(NH3)]Cl3, анионные K4[Fe(CN)6], катион-анионные [Cr(NH3)6] [Fe(CN)6] и нейтральные [PtCl2(NH3)2].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-23.jpg)




![КВАДРАТНЫЙ КОМПЛЕКС [PT(NH3)2CL2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-28.jpg)
![ОКТАЭДРИЧЕСКИЙ КОМПЛЕКСНЫЙ ИОН [COF6]3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-29.jpg)
![ХИМИЧЕСКАЯ СВЯЗЬ В КООРДИНАЦИОННЫХ СОЕДИНЕНИЯХ Образование парамагнитного иона [FeF6]4–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-32.jpg)







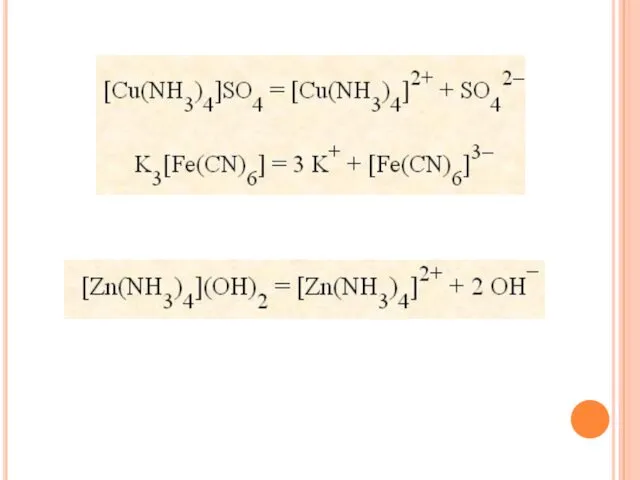
![K3[Fe(CN)6] ↔ K+ + [Fe(CN)6]3- [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- Диссоциация КС по внешней сфере (первичная диссоциация)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-47.jpg)
![[Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)2]+ Ag+ + 2 NH3 Диссоциация КС по внутренней сфере (вторичная диссоциация)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-48.jpg)
![ДИССОЦИАЦИЯ КОМПЛЕКСНОГО СОЕДИНЕНИЯ [NI(NH3)4]SO4 В ВОДНОМ РАСТВОРЕ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52231/slide-49.jpg)




 в Лекция 6
в Лекция 6 презентация Формирование связной речи у детей с заиканием
презентация Формирование связной речи у детей с заиканием Український модерн
Український модерн Реконструкция и реновация особняков России
Реконструкция и реновация особняков России Конструктивные особенности самоходных опрыскивателей серии SP
Конструктивные особенности самоходных опрыскивателей серии SP Воздух и его состав
Воздух и его состав Принципы построения параллельных вычислительных систем
Принципы построения параллельных вычислительных систем Сочинение-описание по картине Т. Н. Яблонской Утро
Сочинение-описание по картине Т. Н. Яблонской Утро Технология разработки СБИС типа СнК на отечественной платформе по заданным алгоритмам
Технология разработки СБИС типа СнК на отечественной платформе по заданным алгоритмам Конспект урока по математике Решение примеров на нахождение неизвестного слагаемого
Конспект урока по математике Решение примеров на нахождение неизвестного слагаемого Организация торговли на борту ВС. Обучение бортпроводников
Организация торговли на борту ВС. Обучение бортпроводников Организация работы банковской системы в области противодействия легализации (отмыванию) доходов, полученных преступным путем
Организация работы банковской системы в области противодействия легализации (отмыванию) доходов, полученных преступным путем Характеристика карьерных дорог
Характеристика карьерных дорог Европейская и русская культурологическая мысль XIX века
Европейская и русская культурологическая мысль XIX века Развитие кооперации в Липецкой области
Развитие кооперации в Липецкой области РМО учителей географии
РМО учителей географии Компания Петро-Композит. Проект Зеленый город
Компания Петро-Композит. Проект Зеленый город Каждой пичужке кормушка. Краевая Акция Экологический марафон
Каждой пичужке кормушка. Краевая Акция Экологический марафон Веселые старты, посвященные Дню Защитника Отечества. Выше голову будущий солдат
Веселые старты, посвященные Дню Защитника Отечества. Выше голову будущий солдат Скелетная травма
Скелетная травма Проект моя Родина
Проект моя Родина Прекращение трудового договора по инициативе работодателя
Прекращение трудового договора по инициативе работодателя Сортировка в массивах. Методы сортировки
Сортировка в массивах. Методы сортировки Сказка как средство развития эмоциональной сферы у дошкольников
Сказка как средство развития эмоциональной сферы у дошкольников Классный час 2014 год - год культуры России Диск
Классный час 2014 год - год культуры России Диск Аркадий и Борис Стругацкие
Аркадий и Борис Стругацкие She/from. He/from
She/from. He/from Презентация к родительскому собранию на тему: Фейерверки и пиротехника. Друзья или враги?
Презентация к родительскому собранию на тему: Фейерверки и пиротехника. Друзья или враги?