Содержание
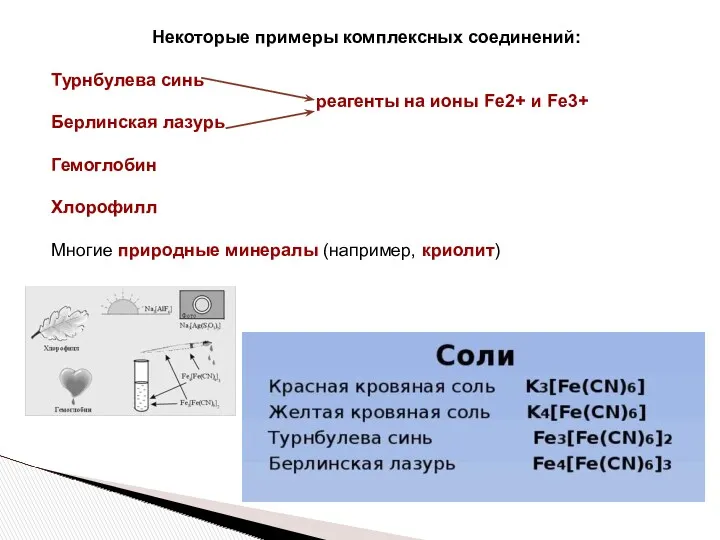
- 2. Некоторые примеры комплексных соединений: Турнбулева синь реагенты на ионы Fe2+ и Fe3+ Берлинская лазурь Гемоглобин Хлорофилл
- 3. Комплексными называются химические соединения сложного состава, состоящие из центрального атома и лигандов, скоординированных вокруг центрального атома
- 4. Что такое «комплексные соединения» Комплексное соединение – это вещество, в узлах кристаллической решётки которого находятся сложные
- 5. Альфред Вернер 1866-1919 Швейцарский химик, выдвинувший и развивший координационную теорию строения комплексных соединений Лауреат Нобелевской премии
- 6. Строение Большинство комплексных соединений имеют внутреннюю и внешнюю сферы. Записывая химические формулы комплексных соединений, внутреннюю сферу
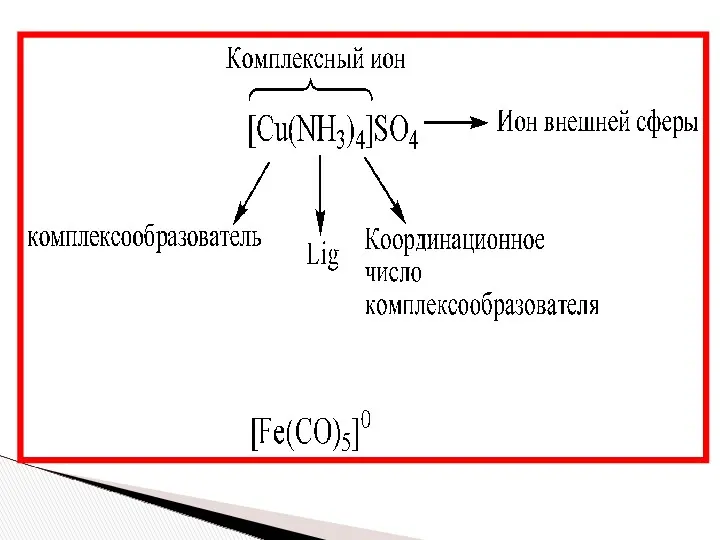
- 7. Комплексные соединения состоят из: комплексообразователей (Ме, реже неметаллы: Si, P и др.); лигандов (ионов или полярных
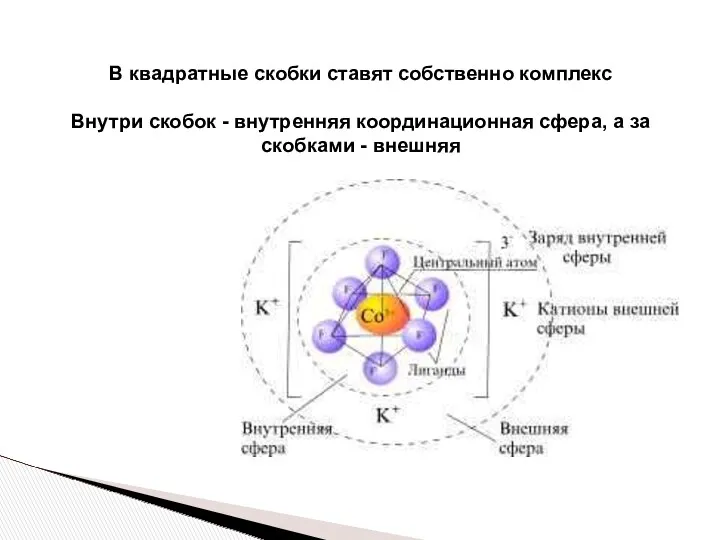
- 8. Комплексный ион, состоящий из комплексообразователя и лигандов, образует внутреннюю сферу комплексного соединения А вокруг - внешняя
- 10. Комплексообразователь Это положительный ион, имеющий свободные электронные орбитали Комплексообразователем могут быть следующие ионы: Cu2+, Al3+, Fe2+,
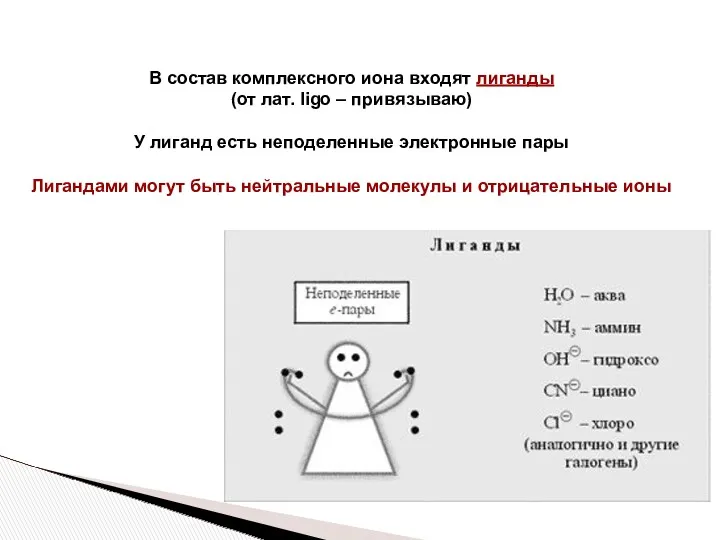
- 11. В состав комплексного иона входят лиганды (от лат. ligo – привязываю) У лиганд есть неподеленные электронные
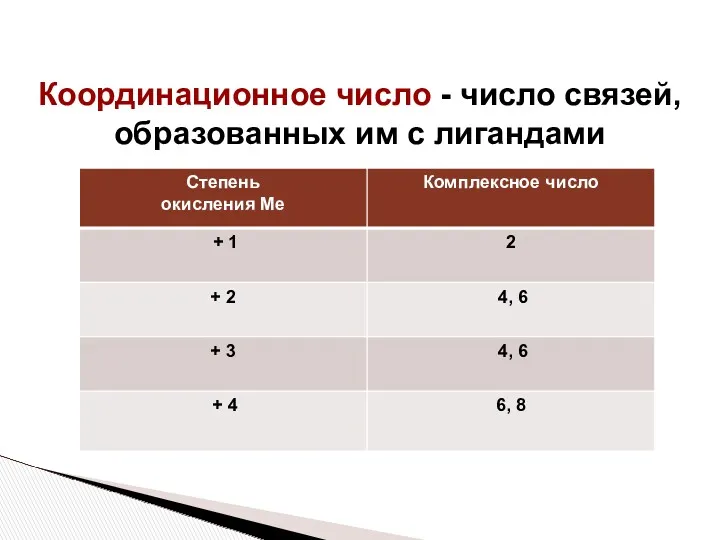
- 12. Важнейшей характеристикой лиганда является его дентантность – число связей, образованных с комплексообразователем
- 13. Классификация лигандов монодентантные лиганды: а) анионы: OH‾, H‾, F‾, Cl‾, Br‾, I‾, CN‾, CNS‾, NO2‾, NO3‾;
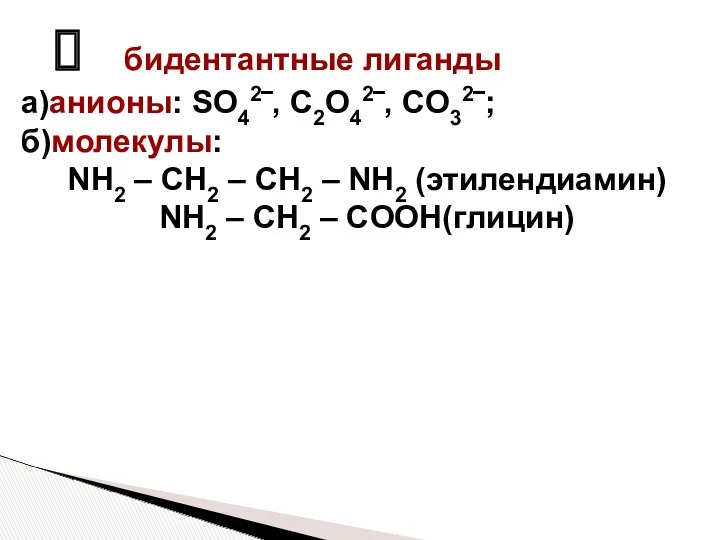
- 14. бидентантные лиганды а)анионы: SO42‾, C2O42‾, CO32‾; б)молекулы: NH2 – CH2 – CH2 – NH2 (этилендиамин) NH2
- 15. полидентантные лиганды Важнейшими из них являются комплексоны – аминополикарбоновые кислоты и их соли
- 16. Если комплексообразователь принимает неподеленные электронные пары лигандов на свои свободные электронные орбитали, то образуется: комплексный ион
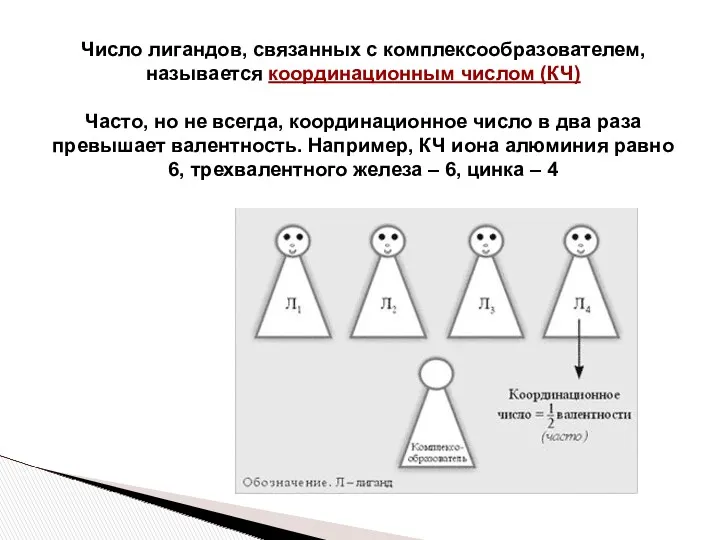
- 17. Число лигандов, связанных с комплексообразователем, называется координационным числом (КЧ) Часто, но не всегда, координационное число в
- 18. Координационное число - число связей, образованных им с лигандами
- 19. В квадратные скобки ставят собственно комплекс Внутри скобок - внутренняя координационная сфера, а за скобками -
- 20. Комплексы (комплексные, координационные соединения) - это молекулы или ионы, обладающие высокой симметрией, имеющие атом в центре
- 21. Квадратный комплекс [Pt(NH3)2Cl2]
- 22. Октаэдрмический комплексный ион [CoF6]3-
- 23. Комплексные соединения классифицируются по заряду комплексов: катионные - [Ni(NH3)4]2+, анионные - [Co(CN)6 ]3-, нейтральные - [Co(NH3)4Сl2]0;
- 24. Номенклатура КС (1960, ИЮПАК) вначале называют катионы, затем анионы. Названия комплексных анионов заканчиваются суффиксом –ат; 2)
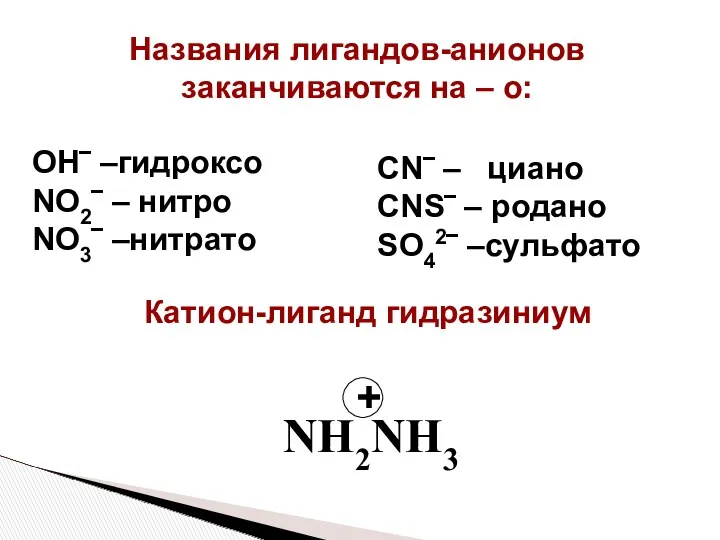
- 25. Названия лигандов-анионов заканчиваются на – о: OH‾ –гидроксо NO2‾ – нитро NO3‾ –нитрато CN‾ – циано
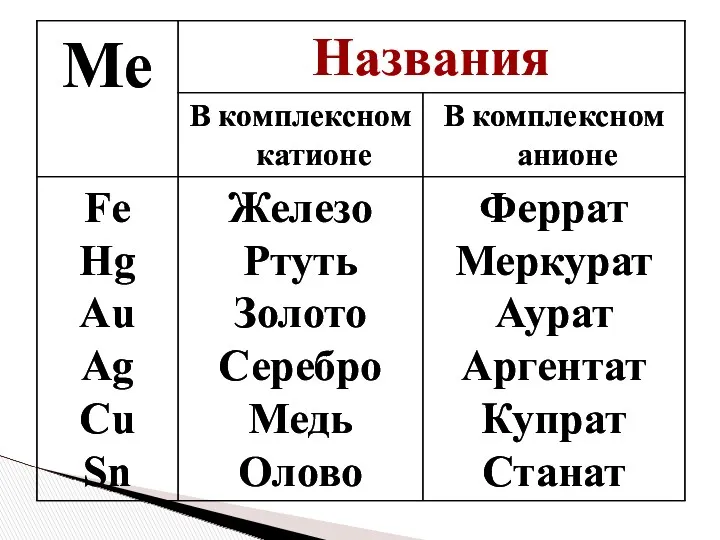
- 26. Названия некоторых комплексообразо-вателей зависит от их положения в КС
- 28. Степень окисления комплексообразователя указывают, если у металла их несколько
- 29. Na[Al(OH)4] натрий тетрагидроксоалюминат [Cu(NH3)4]SO4 тетраамминмедь(II) сульфат NH4[Co(NH3)2(NO2)4] аммоний тетранитродиамминкобальтат(III) [Pt(NH3)2Cl2] дихлородиамминплатина
- 30. Свойства Кислотно-основные свойства комплексных соединений: • При образовании комплекса лиганд передает иону металла часть своей электронной
- 31. Получение комплексных соединений 1. В результате реакций соединения: HgI2 + 2KI (изб.) = K2[HgI4] 2. По
- 32. Комплексные соединения Электролиты Неэлектролиты Кислоты Основания Соли H2[PtCl4] [Ag(NH3)2]OH [Pt(NH3)2Cl2] K4[Fe(CN)6]
- 33. Различают первичную (необратимую) диссоциацию: K4[Fe(CN)6] → 4 K+ + [Fe(CN)6]4‾ и вторичную (обратимую) диссоциацию КС: [Fe(CN)6]4‾
- 34. Константа равновесия, описывающая вторичную диссоциацию КС, называется константой нестойкости (Кн): Кн
- 35. Чем меньше Кн, тем устойчивее комплексное соединение [Ag(NO2)2]‾ [Ag(NH3)2]+ [Ag(CN)2]‾ 1,3∙10‾3 6,8·10‾8 1,0∙10‾21 увеличение устойчивости КС
- 36. Устойчивость комплексов можно охарактеризовать при помощи константы устойчивости (Ку): Ку = 1 Кн
- 37. Причины устойчивости КС лежат в их строении: а) чем меньше ионный радиус комплексообразователя и больше его
- 38. s-Me p-Me d-Me увеличение комплексообразующей способности
- 40. Скачать презентацию












![Квадратный комплекс [Pt(NH3)2Cl2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52235/slide-20.jpg)
![Октаэдрмический комплексный ион [CoF6]3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52235/slide-21.jpg)
![Комплексные соединения классифицируются по заряду комплексов: катионные - [Ni(NH3)4]2+, анионные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52235/slide-22.jpg)



![Na[Al(OH)4] натрий тетрагидроксоалюминат [Cu(NH3)4]SO4 тетраамминмедь(II) сульфат NH4[Co(NH3)2(NO2)4] аммоний тетранитродиамминкобальтат(III) [Pt(NH3)2Cl2] дихлородиамминплатина](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52235/slide-28.jpg)


![Комплексные соединения Электролиты Неэлектролиты Кислоты Основания Соли H2[PtCl4] [Ag(NH3)2]OH [Pt(NH3)2Cl2] K4[Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52235/slide-31.jpg)
![Различают первичную (необратимую) диссоциацию: K4[Fe(CN)6] → 4 K+ + [Fe(CN)6]4‾](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52235/slide-32.jpg)

![Чем меньше Кн, тем устойчивее комплексное соединение [Ag(NO2)2]‾ [Ag(NH3)2]+ [Ag(CN)2]‾ 1,3∙10‾3 6,8·10‾8 1,0∙10‾21 увеличение устойчивости КС](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52235/slide-34.jpg)



 Преобразование видеопотока в поток семантической информации
Преобразование видеопотока в поток семантической информации Здоровьесберегающие технологии. Метод В. Ф. Базарного
Здоровьесберегающие технологии. Метод В. Ф. Базарного Конструирование радиоэлектронной аппаратуры
Конструирование радиоэлектронной аппаратуры Порядок расчета отпускных и выплат по нетрудоспособности
Порядок расчета отпускных и выплат по нетрудоспособности Исследовательская работа Вечен подвиг народа
Исследовательская работа Вечен подвиг народа Малышам о безопасности Диск
Малышам о безопасности Диск Презентация Явление природы
Презентация Явление природы Организация деятельности первичного отделения РДШ на базе отделения дополнительного образования детей: перспективы развития
Организация деятельности первичного отделения РДШ на базе отделения дополнительного образования детей: перспективы развития Презентация к уроку основ православной культуры Высокий иконостас.
Презентация к уроку основ православной культуры Высокий иконостас. Последствия извержения вулканов. Защита населения
Последствия извержения вулканов. Защита населения Портфоліо. Кожемяко Анастасія Володимирівна
Портфоліо. Кожемяко Анастасія Володимирівна Поверхностно-диффузионная модификация ПВХ изделий эпоксидными смолами. Магистерская диссертация
Поверхностно-диффузионная модификация ПВХ изделий эпоксидными смолами. Магистерская диссертация Компоненты системы безопасности
Компоненты системы безопасности Классный час Путешествие в стану Добра
Классный час Путешествие в стану Добра Высокое Возрождение
Высокое Возрождение Внедрение регионального компонента в учебный процесс
Внедрение регионального компонента в учебный процесс План организации и проведения конференции Медицинская весна – 2016
План организации и проведения конференции Медицинская весна – 2016 Война во Вьетнаме 1 ноября 1957 - 30 апреля 1975
Война во Вьетнаме 1 ноября 1957 - 30 апреля 1975 Внешность человека
Внешность человека Беременность и заболевания сердечно-сосудистой системы
Беременность и заболевания сердечно-сосудистой системы Роль твердой фазы в формировании осадков. Рост ледяной фазы.Тема 5 2013
Роль твердой фазы в формировании осадков. Рост ледяной фазы.Тема 5 2013 Фонтанная арматура
Фонтанная арматура Общественное движение 1830-х – 1850-х гг
Общественное движение 1830-х – 1850-х гг Религиоведение. Функции и роль религии в обществе
Религиоведение. Функции и роль религии в обществе Доклад на тему Методики мониторинга личностных, предметных и метапредметных результатов в условиях новых ФГОС, 2014 г.
Доклад на тему Методики мониторинга личностных, предметных и метапредметных результатов в условиях новых ФГОС, 2014 г. Опробование. Основные понятия
Опробование. Основные понятия Современные технологии обучения
Современные технологии обучения Сборка ПК с монитором, с бюджетом 200000р на Advanced Micro Devices
Сборка ПК с монитором, с бюджетом 200000р на Advanced Micro Devices