Растворимость газов в газах
закон Дальтона:
Общее давление газовой смеси равно сумме парциальных
давлений всех входящих в неё газов.
Растворимость газов в жидкостях
зависит от факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (электролитов).
X - мольная доля газа в растворе; ∆Н - тепловой эффект растворения 1 моля газа в его насыщенном растворе
Формула Сеченова: X и Хо - растворимость газа в чистом растворителе и в растворе электролита с концентрацией С
Зависимость растворимости газов от давления выражается законом Генри: Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
C = k·P
С - концентрация раствора газа в жидкости; k - коэффициент пропорциональности, зависящий от природы газа (коэффициент Генри)



 Что такое зоопарк
Что такое зоопарк Историческое путешествие по Крыму
Историческое путешествие по Крыму Крытые склады, грузовые механизмы этих складов. Устройство крытых железнодорожных складов
Крытые склады, грузовые механизмы этих складов. Устройство крытых железнодорожных складов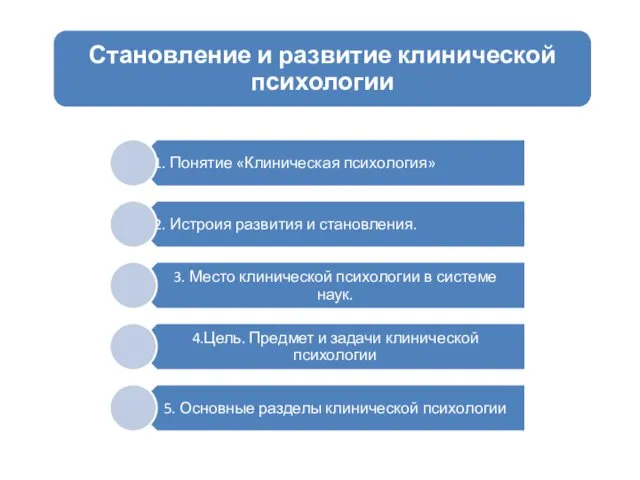 Становление и развитие клинической психологии
Становление и развитие клинической психологии Методы исследования и охрана атмосферного воздуха
Методы исследования и охрана атмосферного воздуха Компоненты и устройства радиофотоники. Лекция 1
Компоненты и устройства радиофотоники. Лекция 1 Электрические аппараты и приборы, электрические цепи тепловоза, электрические цепи электровоза
Электрические аппараты и приборы, электрические цепи тепловоза, электрические цепи электровоза Религии мира и книжная культура
Религии мира и книжная культура Презентация к собранию
Презентация к собранию Африка
Африка ВПР 5 кл
ВПР 5 кл Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Резьба
Резьба Coding schemes
Coding schemes Презентация к классному часу Профессия - журналист 4 класс
Презентация к классному часу Профессия - журналист 4 класс Основы проводной связи. Телефонная связь. Звуковые колебания. Коммутируемые сети
Основы проводной связи. Телефонная связь. Звуковые колебания. Коммутируемые сети Глутаминовая кислота и ГАМК – главные медиаторы ЦНС: синтез, типы рецепторов, инактивация
Глутаминовая кислота и ГАМК – главные медиаторы ЦНС: синтез, типы рецепторов, инактивация Детская площадка в melis stoke park
Детская площадка в melis stoke park Общие сведения о геодезических сетях. Методы построения геодезических сетей
Общие сведения о геодезических сетях. Методы построения геодезических сетей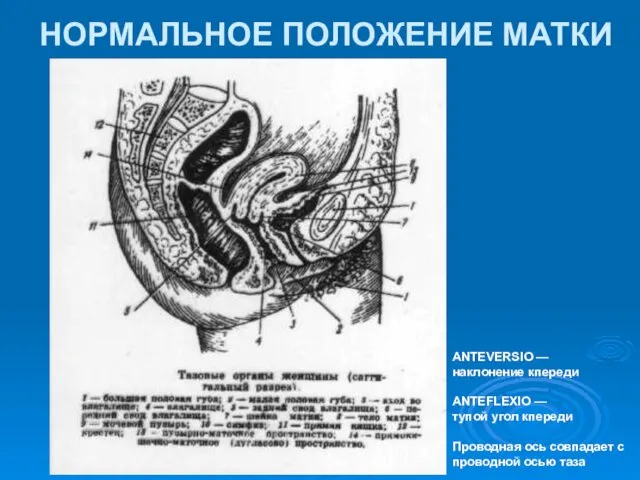 Нормальное положение матки
Нормальное положение матки Основные положения о сборке самолетов и вертолетов
Основные положения о сборке самолетов и вертолетов Концепция формирования толерантного поведения младших школьников в рамках ФГОС
Концепция формирования толерантного поведения младших школьников в рамках ФГОС Библия
Библия Инженерные коммуникации в доме
Инженерные коммуникации в доме Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Поняття про полімери на прикладі поліетилену. Використання поліетилену. 9 клас
Поняття про полімери на прикладі поліетилену. Використання поліетилену. 9 клас Первые христиане и их учение
Первые христиане и их учение День России. Результаты работы групп
День России. Результаты работы групп