Содержание
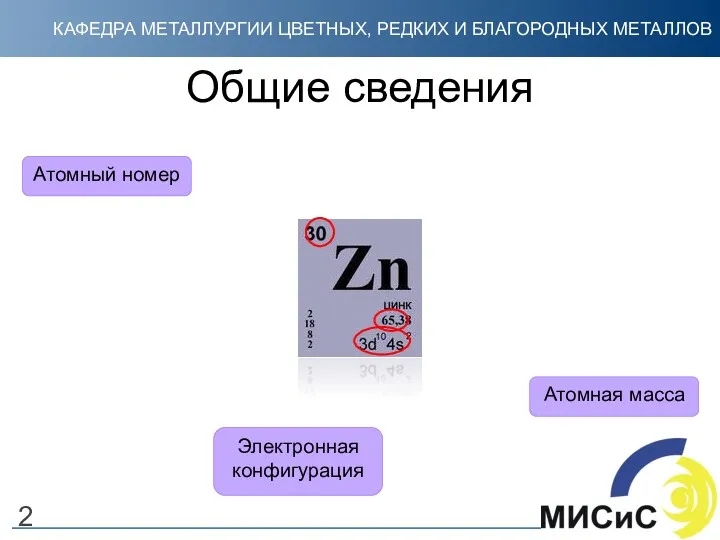
- 2. Общие сведения Атомный номер Атомная масса Электронная конфигурация 2
- 3. Физические свойства Серебристо-белый металл, блестящий в изломе В холодном состоянии цинк ломок, при Т=100–150 °C –
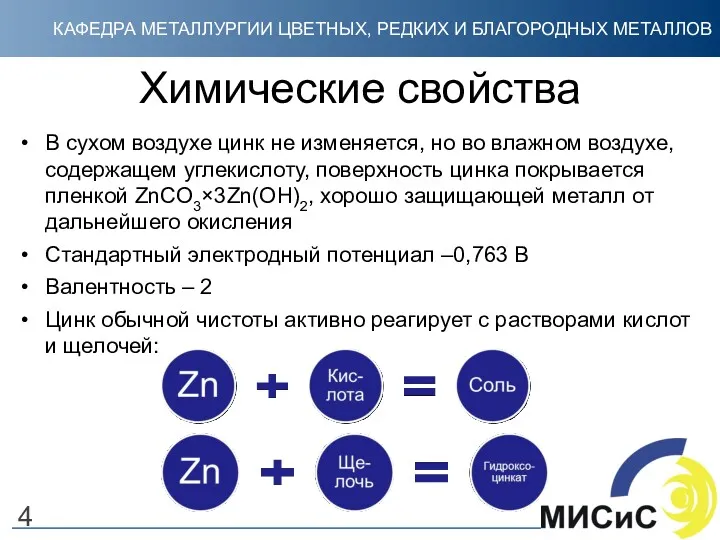
- 4. Химические свойства В сухом воздухе цинк не изменяется, но во влажном воздухе, содержащем углекислоту, поверхность цинка
- 5. Минералы цинка Сфалерит α-ZnS 5
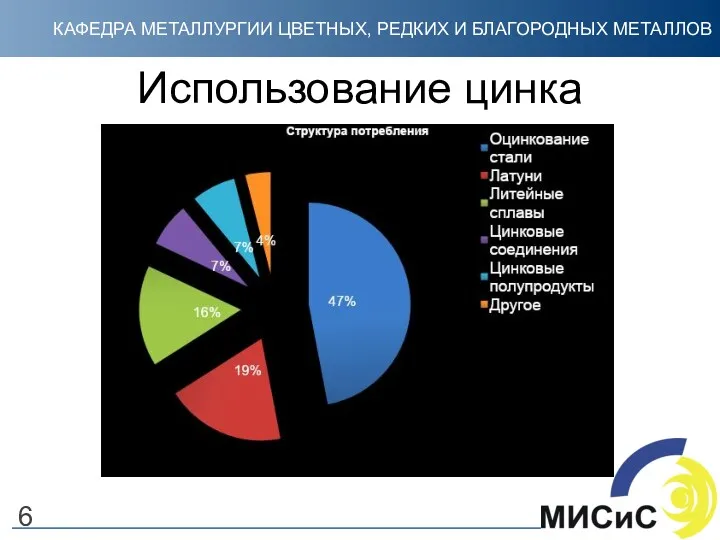
- 6. Использование цинка 6
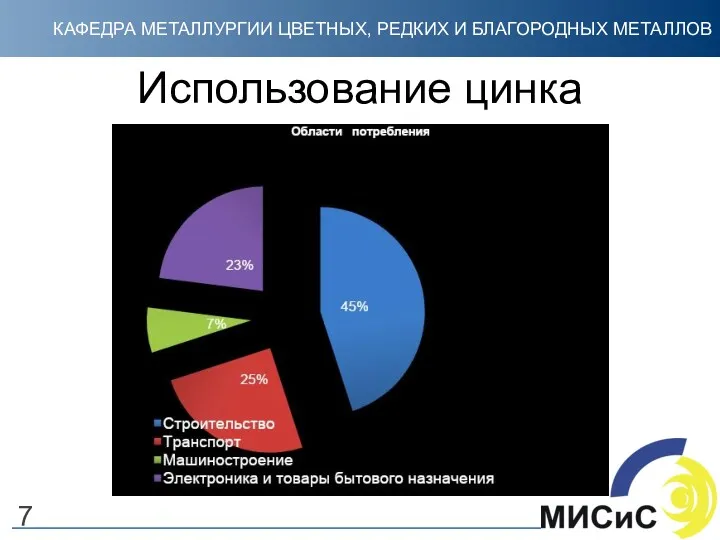
- 7. Использование цинка 7
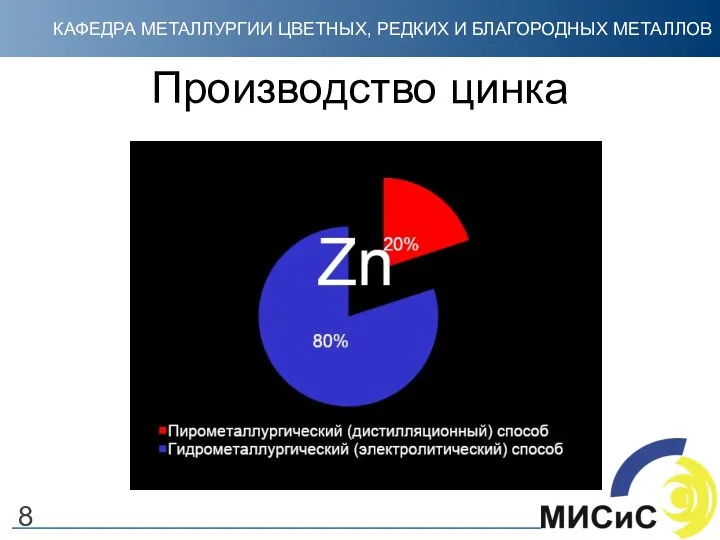
- 8. Производство цинка 8
- 9. Пирометаллургический способ получения цинка Пирометаллургический (дистилляционный) способ основан на химических реакциях: 2ZnS + 3O2 = 2ZnO
- 10. Гидрометаллургический способ получения цинка Гидрометаллургический (электролитический) способ основан на химических реакциях: 2ZnS + 3O2 = 2ZnO
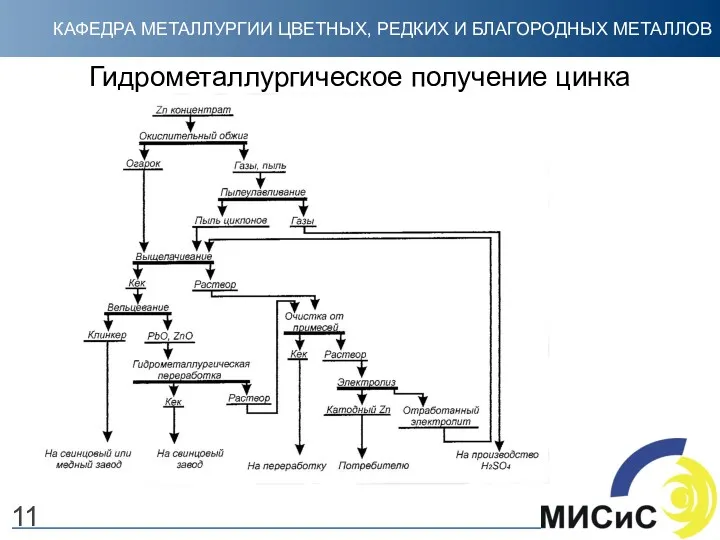
- 11. Гидрометаллургическое получение цинка 11
- 12. Обжиг сульфидных цинковых концентратов Обжиг является первой операцией в любой схеме получения цинка и представляет собой
- 13. Обжиг сульфидных цинковых концентратов При гидрометаллургической переработке окислительный обжиг проводят с частичной сульфатизацией, чтобы сульфатом цинка
- 14. Обжиг сульфидных цинковых концентратов СУЛЬФАТООБРАЗОВАНИЕ Сульфаты цинка образуются при обжиге по следующим реакциям: 2SO2 + O2
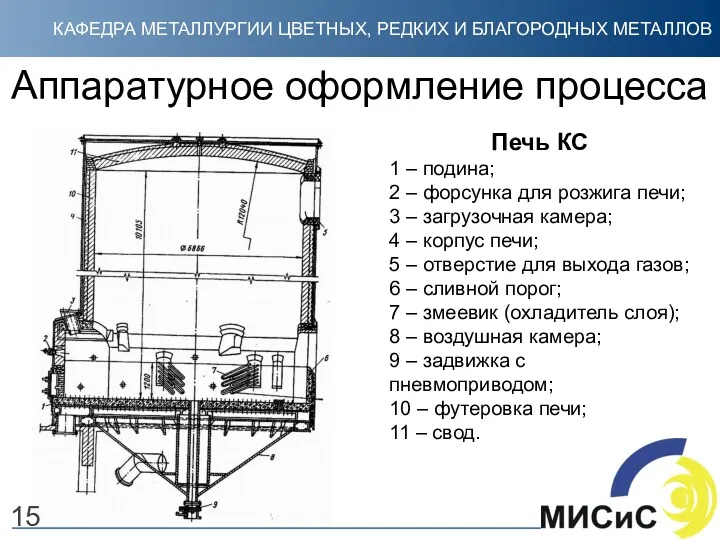
- 15. Аппаратурное оформление процесса Печь КС 1 – подина; 2 – форсунка для розжига печи; 3 –
- 16. Выщелачивание цинкового огарка 16 Выщелачивание огарка и пылей проводится по непрерывной (или периодической) противоточной замкнутой технологической
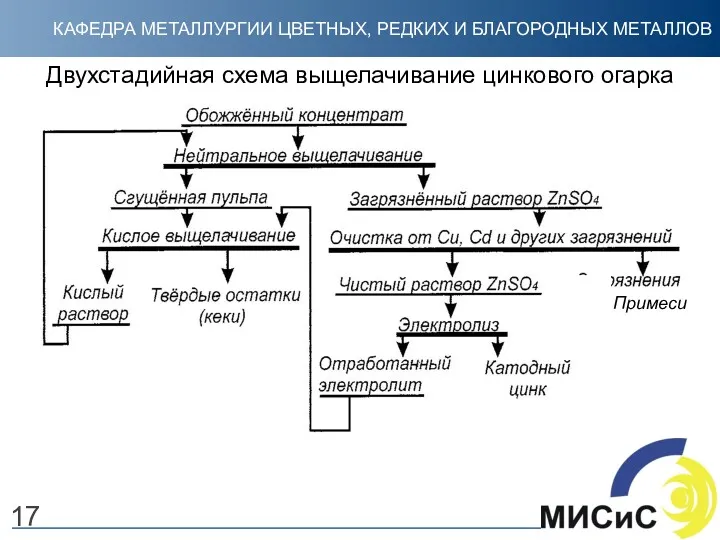
- 17. Двухстадийная схема выщелачивание цинкового огарка 17 Примеси
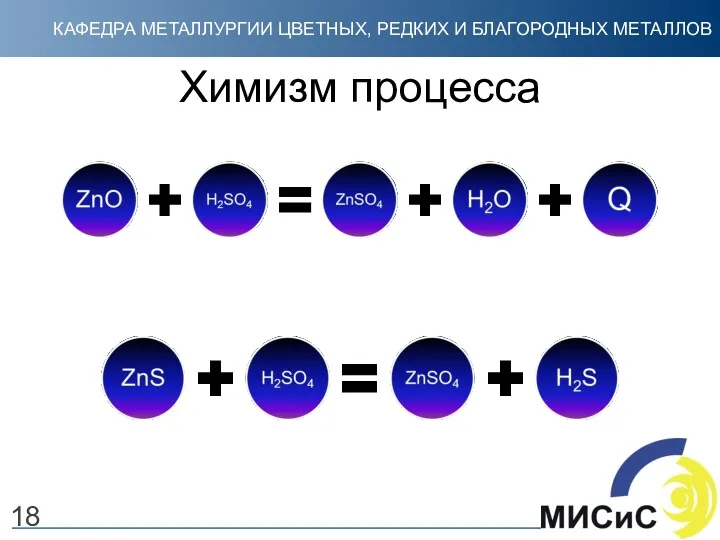
- 18. Химизм процесса 18
- 19. Технология двухстадийного выщелачивания цинкового огарка 19 На нейтральное выщелачивание поступают, часть отработанного электролита, фильтраты кислого выщелачивания
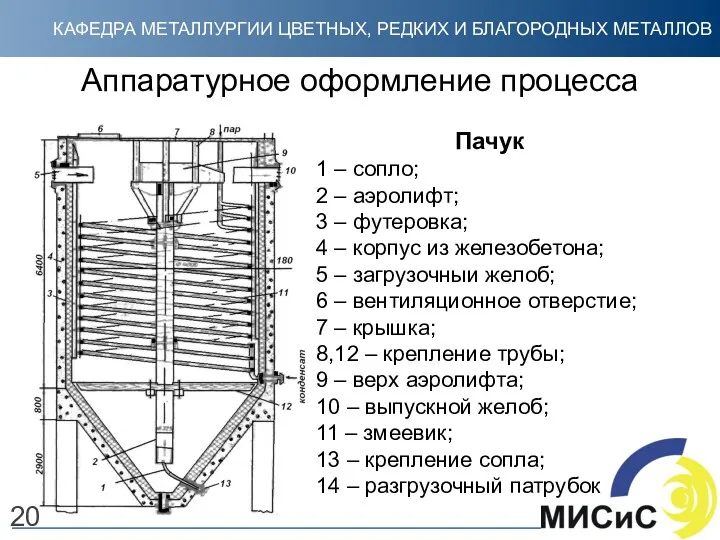
- 20. Аппаратурное оформление процесса Пачук 1 – сопло; 2 – аэролифт; 3 – футеровка; 4 – корпус
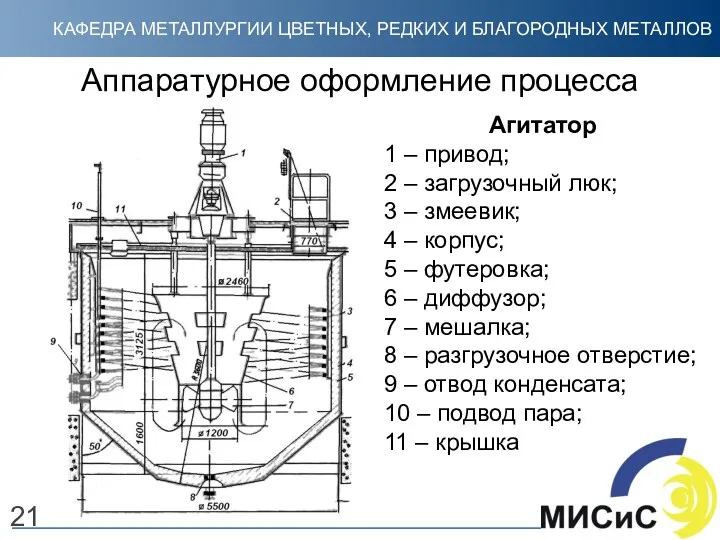
- 21. Агитатор 1 – привод; 2 – загрузочный люк; 3 – змеевик; 4 – корпус; 5 –
- 22. 22
- 23. Методы очистки растворов от примесей 23 Гидролитическая очистка – процесс взаимодействия воды с катионами металлов, сопровождающийся
- 24. Гидролитическая очистка цинковых растворов от примесей 24 В общем виде реакция гидролиза катиона металла выражается уравнением
- 25. Гидролитическая очистка цинковых растворов от примесей 25 В процессе нейтрального выщелачивания при постепенном повышении рН растворов
- 26. Очистка цинковых растворов цементацией цинковым порошком 26 В основе процесса цементации лежит ионизация металла-цементатора: Zn →
- 27. Очистка цинковых растворов цементацией цинковым порошком 27 При очистке раствора от меди и кадмия протекают реакции:
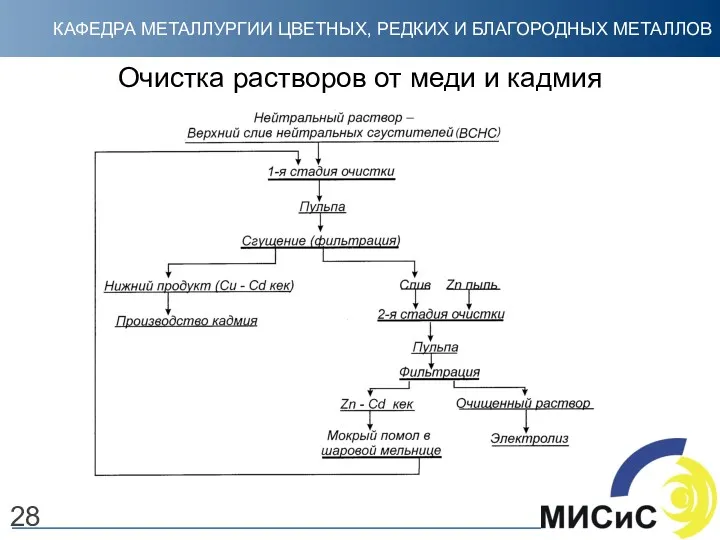
- 28. Очистка растворов от меди и кадмия 28
- 29. Химические способы очистки цинковых растворов 29 Очистка от кобальта. Допустимый предел накопления кобальта в растворе составляет
- 30. Химические способы очистки цинковых растворов (продолжение) 30 Очистка от фтора Очистку раствора проводят оксидом или сульфатом
- 31. Электролиз растворов сульфата цинка 31 Состав очищенного нейтрального раствора сульфата цинка, поступающего на электролиз: - г/л:
- 32. Электролиз растворов сульфата цинка 32 В процессе электролиза применяют свинцово-серебряные аноды (0,5-0,9 % Ag), с материалом
- 33. Электролиз растворов сульфата цинка 33 Перенапряжение водорода зависит от: 1) материала катода: катод Au Ag Ni
- 34. Электролиз растворов сульфата цинка 34 Перенапряжение водорода (продолжение) В кислых водных растворах катион водорода существует в
- 35. Электролиз растворов сульфата цинка 35 Выход по току (ВТ) – отношение количества цинка, фактически полученного при
- 36. Электролиз растворов сульфата цинка 36 Выход по току (продолжение) 3) от температуры электролита С повышением температуры
- 37. Электролиз растворов сульфата цинка 37 Напряжение на ванне при электролизе и расход энергии Напряжение на ванне
- 38. Электролиз растворов сульфата цинка 38 Напряжение на ванне зависит от плотности тока температуры кислотности электролита расстояния
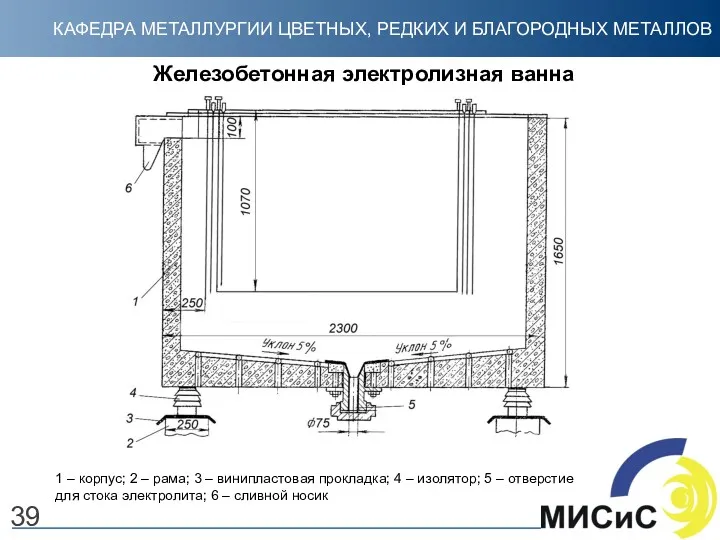
- 39. Железобетонная электролизная ванна 39 1 – корпус; 2 – рама; 3 – винипластовая прокладка; 4 –
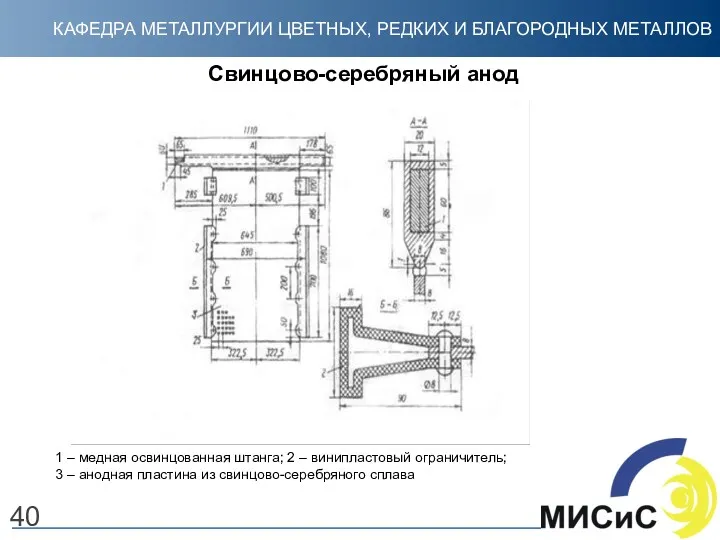
- 40. Свинцово-серебряный анод 40 1 – медная освинцованная штанга; 2 – винипластовый ограничитель; 3 – анодная пластина
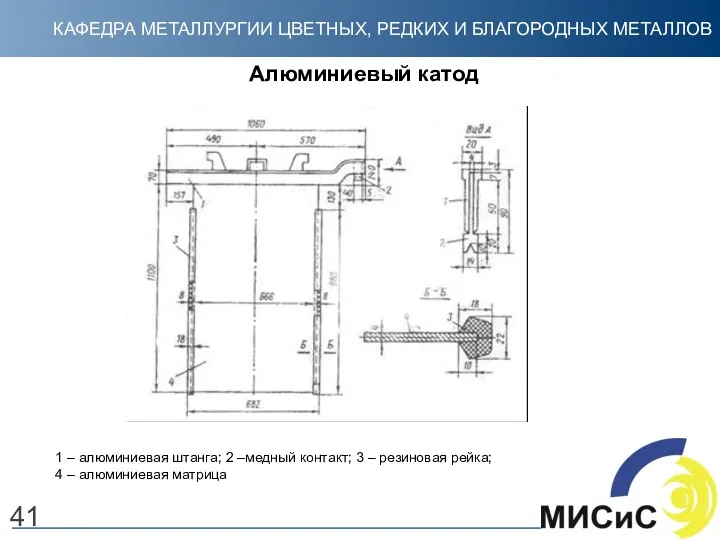
- 41. Алюминиевый катод 41 1 – алюминиевая штанга; 2 –медный контакт; 3 – резиновая рейка; 4 –
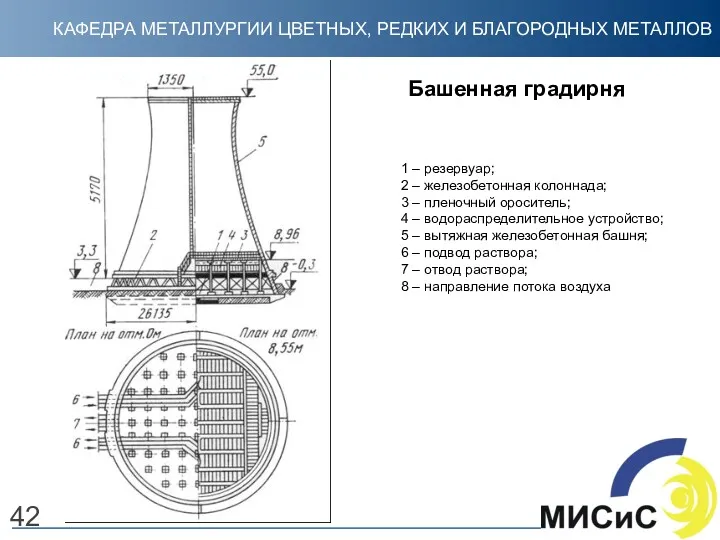
- 42. Башенная градирня 42 1 – резервуар; 2 – железобетонная колоннада; 3 – пленочный ороситель; 4 –
- 43. Турбулентный контактный абсорбер для охлаждения электролита 43 1 – люк; 2 – входное отверстие; 3 –
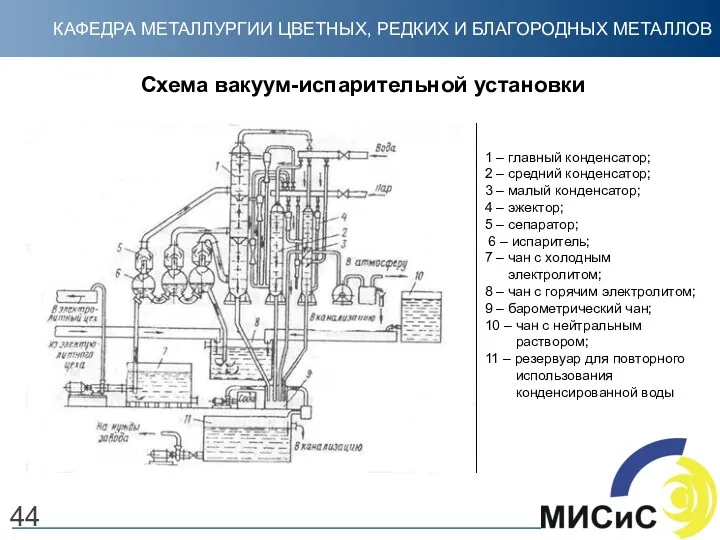
- 44. Схема вакуум-испарительной установки 44 1 – главный конденсатор; 2 – средний конденсатор; 3 – малый конденсатор;
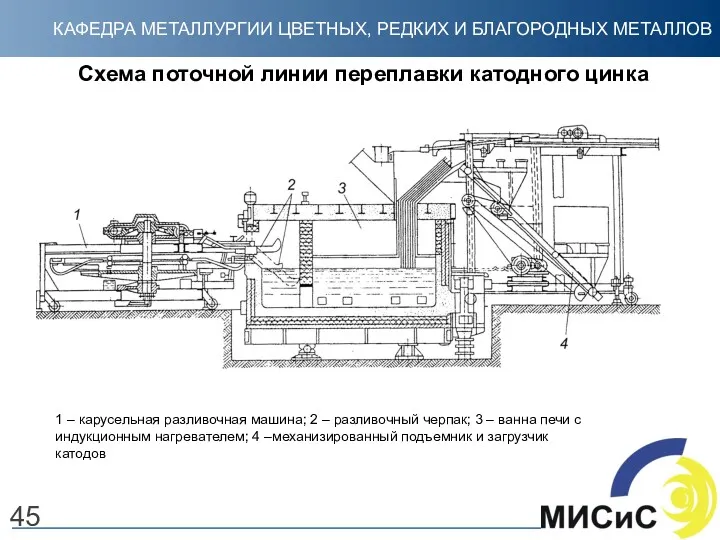
- 45. Схема поточной линии переплавки катодного цинка 45 1 – карусельная разливочная машина; 2 – разливочный черпак;
- 46. Пирометаллургический способ получения цинка Пирометаллургический (дистилляционный) способ основан на химических реакциях: 2ZnS + 3O2 = 2ZnO
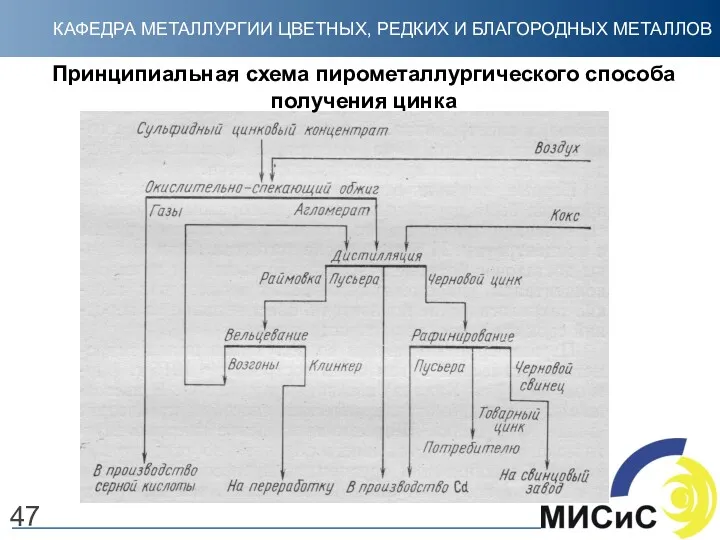
- 47. Принципиальная схема пирометаллургического способа получения цинка 47
- 48. Особенности обжига перед дистилляцией Обжиг сульфидных цинковых концентратов проводят в две стадии Применяемые технологические схемы обжига
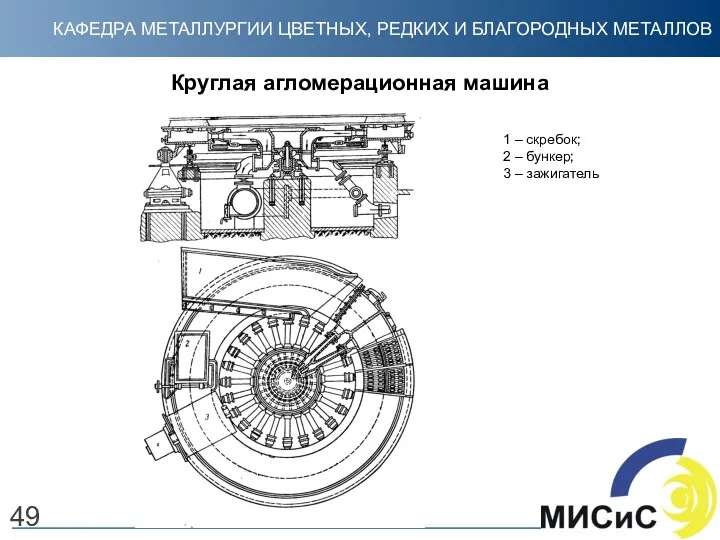
- 49. Круглая агломерационная машина 1 – скребок; 2 – бункер; 3 – зажигатель 49
- 50. Дистилляция цинка Дистилляционный способ получения цинка основан на физико- химических свойствах металлического цинка и его соединений:
- 51. Дистилляция цинка (продолжение) Дистилляционный процесс включает четыре основные стадии: 1. Восстановление оксида цинка до металла 2.
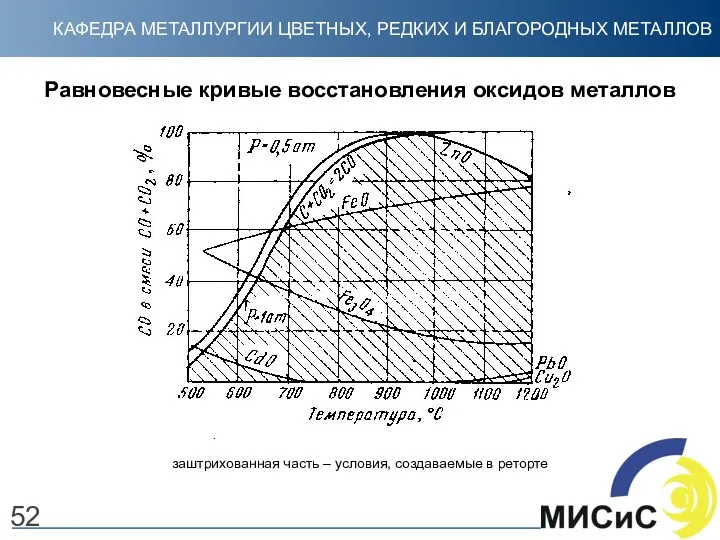
- 52. 52 Равновесные кривые восстановления оксидов металлов заштрихованная часть – условия, создаваемые в реторте
- 53. Дистилляция цинка (продолжение) Оксид цинка может восстанавливаться и железом ZnO + Fe = Zn + FeO
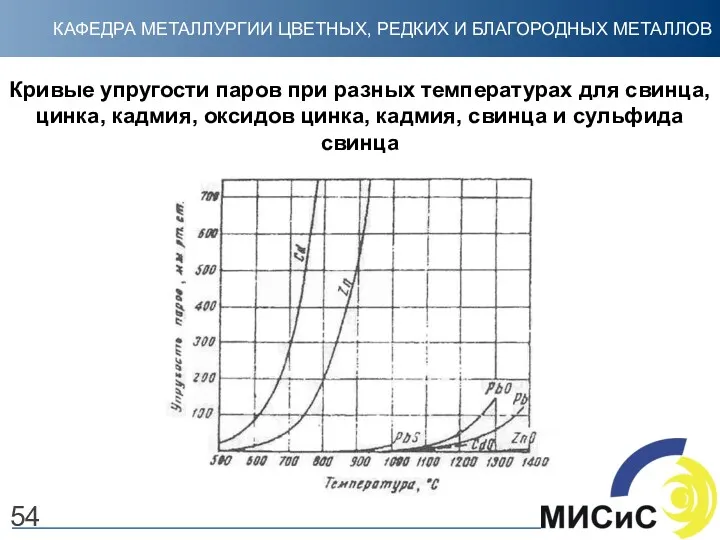
- 54. 54 Кривые упругости паров при разных температурах для свинца, цинка, кадмия, оксидов цинка, кадмия, свинца и
- 55. Поведение металлов-примесей при дистилляции Свинец частично испаряется и, конденсируясь, загрязняет цинк. Большая часть свинца остается и
- 56. Конденсация паров цинка Цинк в момент восстановления находится в парообразном состоянии. Согласно приведенной зависимости (слайд 57),
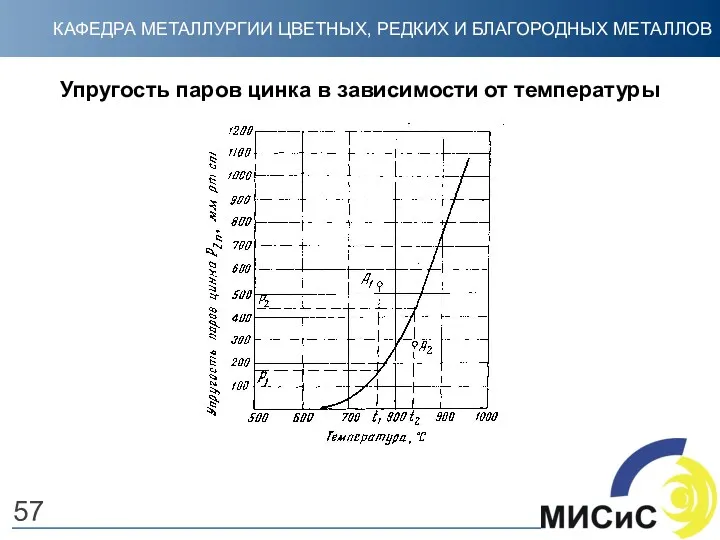
- 57. 57 Упругость паров цинка в зависимости от температуры
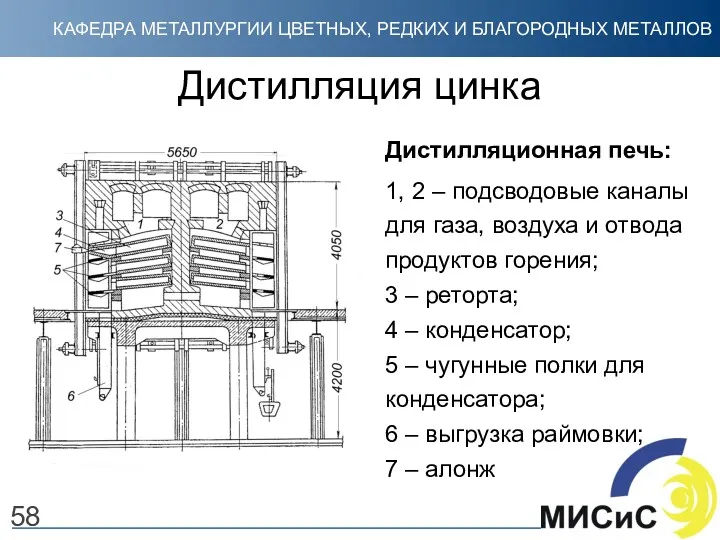
- 58. Дистилляция цинка Дистилляционная печь: 1, 2 – подсводовые каналы для газа, воздуха и отвода продуктов горения;
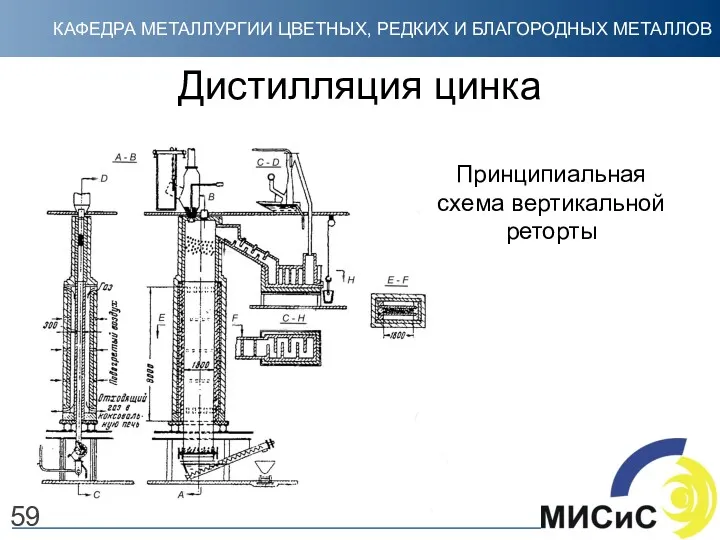
- 59. Дистилляция цинка Принципиальная схема вертикальной реторты 59
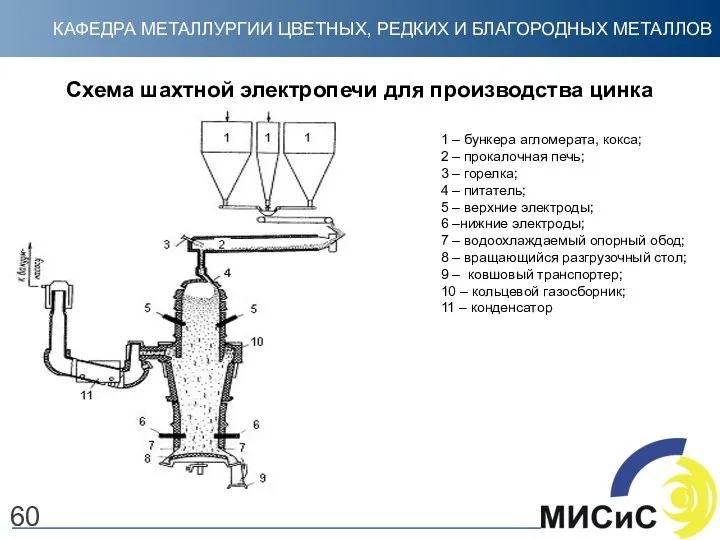
- 60. 60 Схема шахтной электропечи для производства цинка 1 – бункера агломерата, кокса; 2 – прокалочная печь;
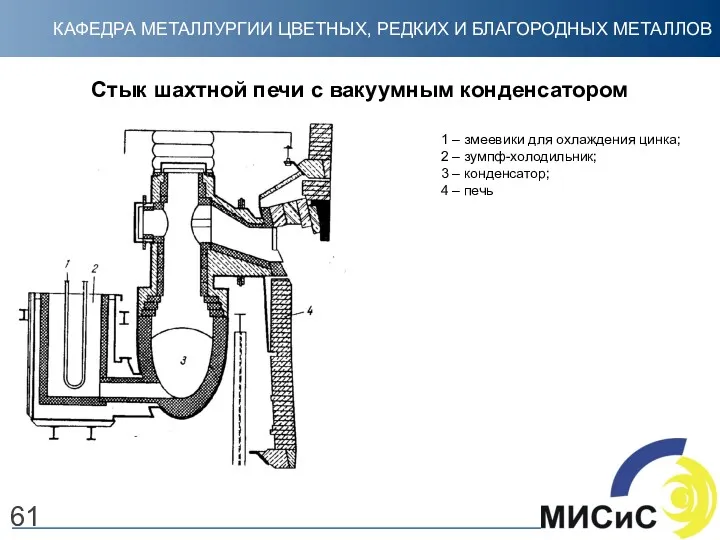
- 61. 61 Стык шахтной печи с вакуумным конденсатором 1 – змеевики для охлаждения цинка; 2 – зумпф-холодильник;
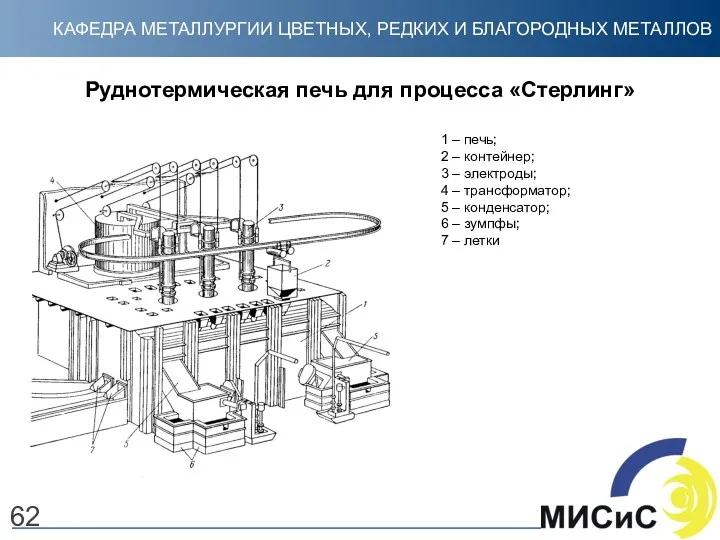
- 62. 62 Руднотермическая печь для процесса «Стерлинг» 1 – печь; 2 – контейнер; 3 – электроды; 4
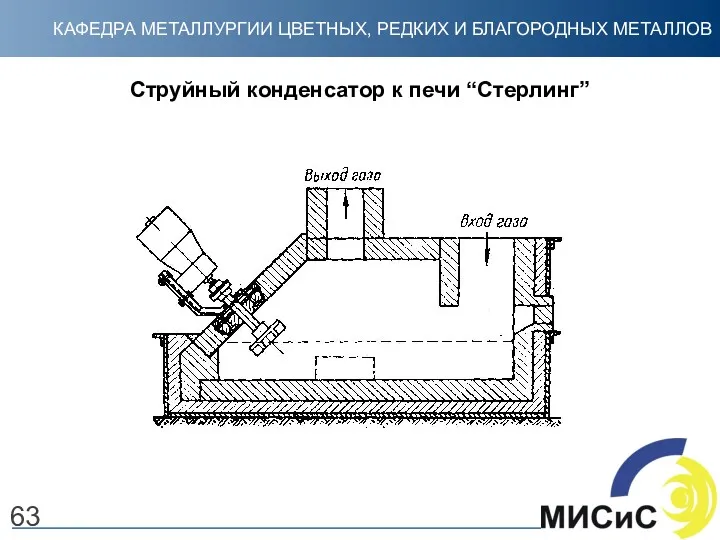
- 63. 63 Струйный конденсатор к печи “Стерлинг”
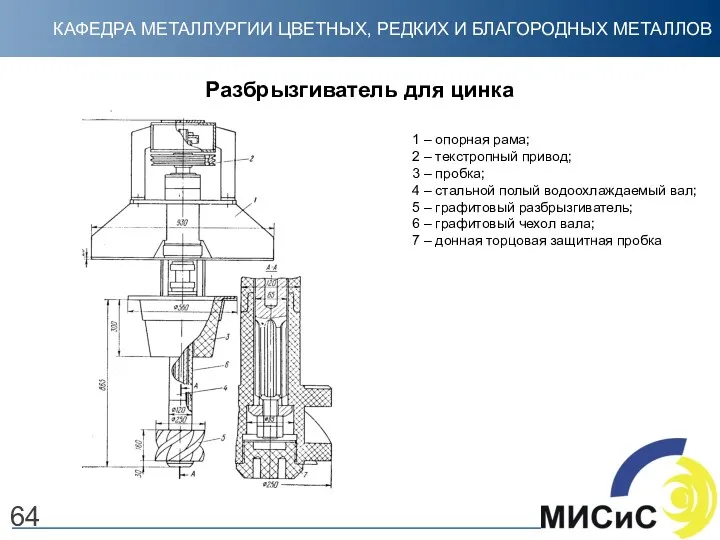
- 64. 64 Разбрызгиватель для цинка 1 – опорная рама; 2 – текстропный привод; 3 – пробка; 4
- 65. Плавка в шахтных печах с жидкостной конденсацией цинка (Процесс «Imperial-Smelting») Сущность процесса. Свинцово-цинковую шихту обжигают и
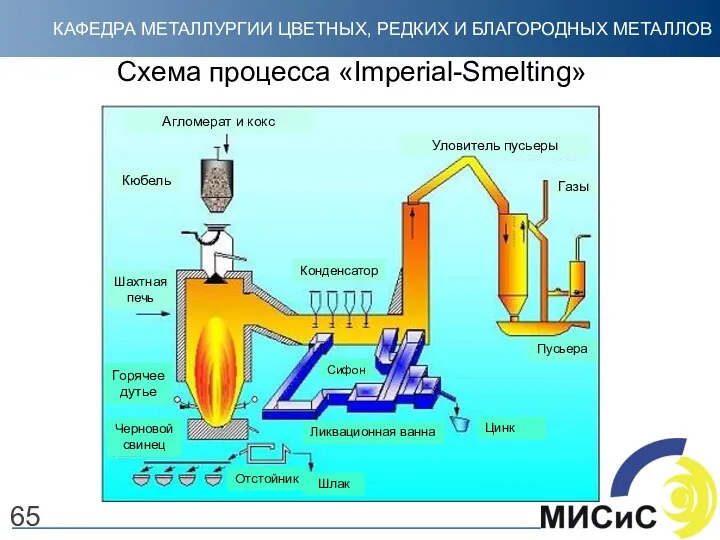
- 66. Схема процесса «Imperial-Smelting» Пусьера 65
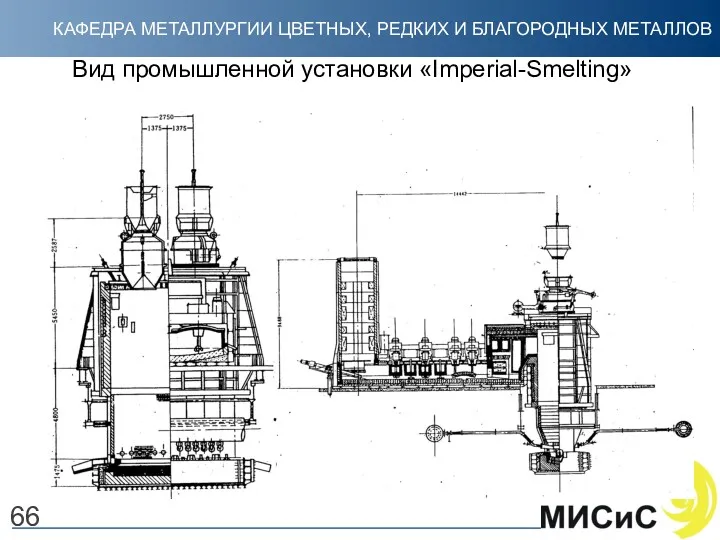
- 67. Вид промышленной установки «Imperial-Smelting» 66
- 68. Особенности технологии процесса «Imperial-Smelting» (продолжение) В условиях шахтной плавки прочность и пористость агломерата, а также газопроницаемость
- 69. Особенности технологии процесса «Imperial-Smelting» (продолжение) Присутствие свинца в шихте способствует получению прочного агломерата, он попутно извлекается
- 70. Показатели процесса «Imperial-Smelting» При плавке в черновой (сырой) цинк извлекается 91-93 % металла, 6,5 % теряется
- 71. Переработка цинксодержащих шлаков свинцовой плавки Шлаки свинцовой шахтной плавки содержат 10-14 % Zn, 1-2 % Pb,
- 72. Шлаковозгоночный процесс - фьюмингование Сущность процесса фьюмингования. В ванну расплавленного шлака, нагретого до температуры 1250-1300 °С
- 73. Шлаковозгоночный процесс - фьюмингование Технология процесса. Процесс фьюмингования периодический, осуществляемый циклами. Цикл включает четыре стадии: заливку
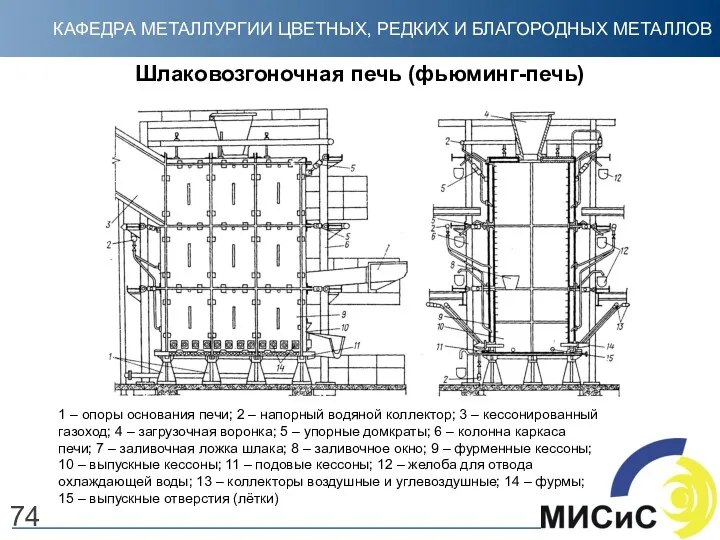
- 74. 74 Шлаковозгоночная печь (фьюминг-печь) 1 – опоры основания печи; 2 – напорный водяной коллектор; 3 –
- 75. Технология процесса (продолжение) Фьюминговая печь – это аппарат шахтного типа с площадью горизонтального сечения 3-24 м2
- 76. Технология процесса (продолжение) После фьюмингования отвальный шлак выпускается из печи и направляется в отвал Газы после
- 77. 77 Схема цепи аппаратов передела фьюмингования шлаков 1 – электрообогреваемый отстойник шахтной печи; 2 - ковш;
- 78. Достоинства фьюминг-процесса Не требует подготовки сырья для переработки, так как использует жидкий шлак шахтной печи Используется
- 79. 79 Вельц-процесс Восстановительно-дистилляционный процесс – вельцевание, нашел широкое распространение для переработки цинковых кеков, при котором можно
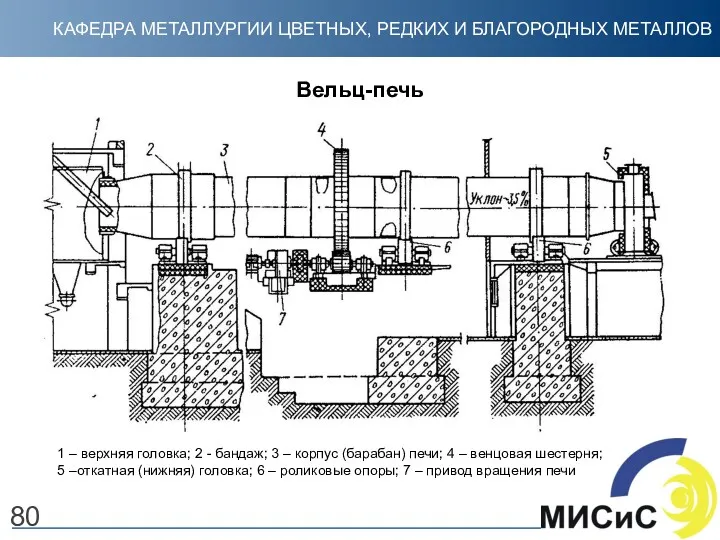
- 80. 80 Вельц-печь 1 – верхняя головка; 2 - бандаж; 3 – корпус (барабан) печи; 4 –
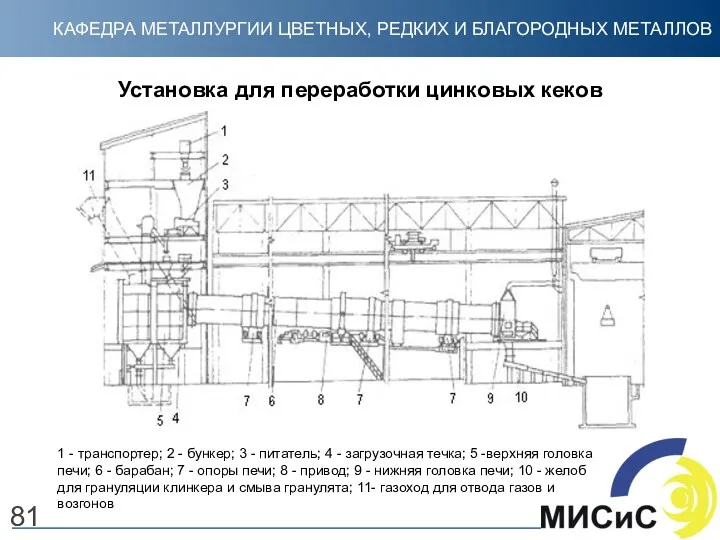
- 81. 81 Установка для переработки цинковых кеков 1 - транспортер; 2 - бункер; 3 - питатель; 4
- 82. 82 Переработка конденсаторной пыли и пусьеры Конденсаторная пыль и пусьера состоит из металлических зерен, покрытых тонкой
- 84. Скачать презентацию













































 Детские страхи: причины возникновения и методы их преодоления
Детские страхи: причины возникновения и методы их преодоления Физиология и принципы культивирования микроорганизмов
Физиология и принципы культивирования микроорганизмов Освобождение от уголовной ответственности и наказания
Освобождение от уголовной ответственности и наказания Деревья осенью
Деревья осенью Гигиена почвы
Гигиена почвы Силы в природе
Силы в природе Я и моя семья
Я и моя семья Презентация Комплекс № 1 Лечебная гимнастика для младших школьников в хореографии.
Презентация Комплекс № 1 Лечебная гимнастика для младших школьников в хореографии. Правление Ивана IV Грозного (внутренняя политика)
Правление Ивана IV Грозного (внутренняя политика) 3-1 (1)
3-1 (1) Лёгкая промышленность. Художественные промыслы Украины
Лёгкая промышленность. Художественные промыслы Украины Рациональная организация учебного процесса.
Рациональная организация учебного процесса. Здоровое питание
Здоровое питание Актуальность курса основы безопасности жизнедеятельности
Актуальность курса основы безопасности жизнедеятельности презентация урока
презентация урока Инструкция по работе в виртуальной образовательной среде
Инструкция по работе в виртуальной образовательной среде Узбекистан Расположение Узбекистана на карте мира
Узбекистан Расположение Узбекистана на карте мира Организация производства и управление предприятием
Организация производства и управление предприятием Профессиональный имидж юриста. Современные представления
Профессиональный имидж юриста. Современные представления Буквенная запись свойств сложения и вычитания(математика 5 класс ,Виленкин)
Буквенная запись свойств сложения и вычитания(математика 5 класс ,Виленкин) Развитие мелкой моторики
Развитие мелкой моторики Успешность работы через использование проектно-исследовательских технологий на уроке иностранного языка и во внеурочной работе
Успешность работы через использование проектно-исследовательских технологий на уроке иностранного языка и во внеурочной работе Вредные привычки. Курение. Алкоголизм. Наркомания
Вредные привычки. Курение. Алкоголизм. Наркомания Презентации к урокам 17, 18, отчасти 24 к курсу История и культура Санкт-Петербурга для 7 класса (уч. Ермолаевой) Маршрут №6 (Невский проспект). 2. Найди и нанеси известные тебе храмы и соборы на карту путешествий. 3. Какие пам
Презентации к урокам 17, 18, отчасти 24 к курсу История и культура Санкт-Петербурга для 7 класса (уч. Ермолаевой) Маршрут №6 (Невский проспект). 2. Найди и нанеси известные тебе храмы и соборы на карту путешествий. 3. Какие пам Магистральные трубопроводы
Магистральные трубопроводы Организация работы по познавательному развитию через экскурсию в краеведческий музей города-курорта Анапа Диск
Организация работы по познавательному развитию через экскурсию в краеведческий музей города-курорта Анапа Диск урок
урок Своя игра по химии
Своя игра по химии