Содержание
- 2. Химические элементы – металлы. Из 114 известных элементов – 92 относятся к металлам. Металлы – это
- 3. Главные особенности элементов металлов. Малое число валентных электронов ( [1-3] ). Сравнительно большие радиусы атомов. Небольшие
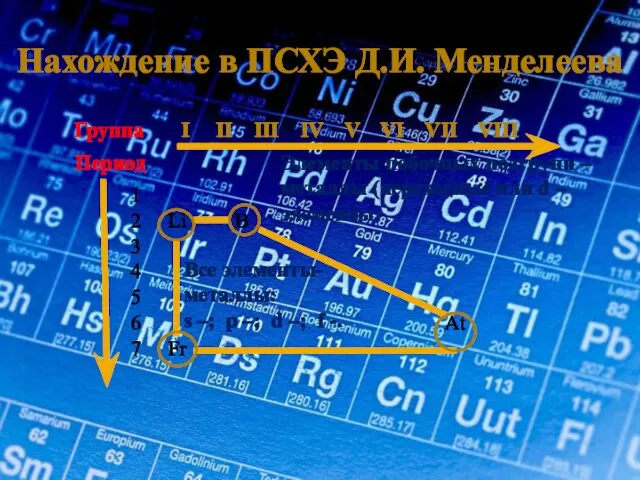
- 4. Нахождение в ПСХЭ Д.И. Менделеева Группа I II III IV V VI VII VIII Период 1
- 5. Изменение свойств в ПСХЭ Д.И. Менделеева Число электронов на внешнем слое не изменяется Радиус атома увеличивается
- 6. Изменение свойств в ПСХЭ Д.И. Менделеева В периоде: Заряды ядер увеличиваются Радиусы атомов уменьшаются Число электронов
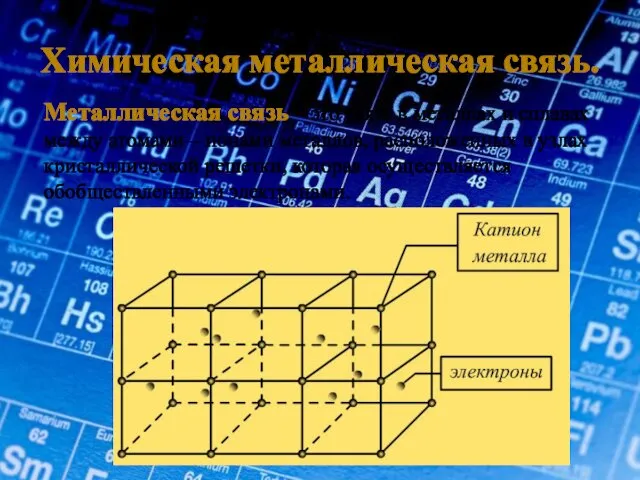
- 7. Химическая металлическая связь. Металлическая связь – это связь в металлах и сплавах между атомами – ионами
- 8. Особенности металлической связи. 1. Небольшое количество электронов одновременно связывают множество атомных ядер. 2. Связь нелокализована. 3.
- 9. Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Пластичность – смещение слоев ионов под
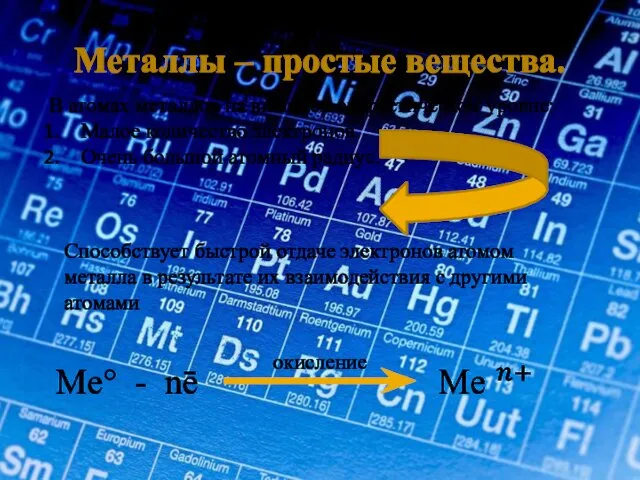
- 10. Металлы – простые вещества. В атомах металлов на внешнем энергетическом уровне: Малое количество электронов. Очень большой
- 11. Электрохимический ряд напряжения металлов. Ме расположены в порядке убывания восстановительных свойств при реакциях в растворах; Ме,
- 12. Электрохимический ряд напряжения металлов. Ме, стоящие в ряду до Al, взаимодействуют с водой с образованием щелочей
- 13. Электрохимический ряд напряжения металлов. На основании восстановительной способности Ме в ряду напряжений УСЛОВНО можно разделить на
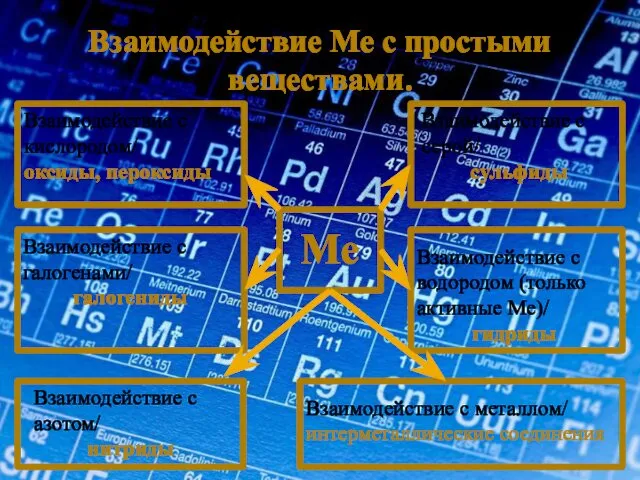
- 14. Взаимодействие Ме с простыми веществами. Ме Взаимодействие с кислородом/ оксиды, пероксиды Взаимодействие с серой/ сульфиды Взаимодействие
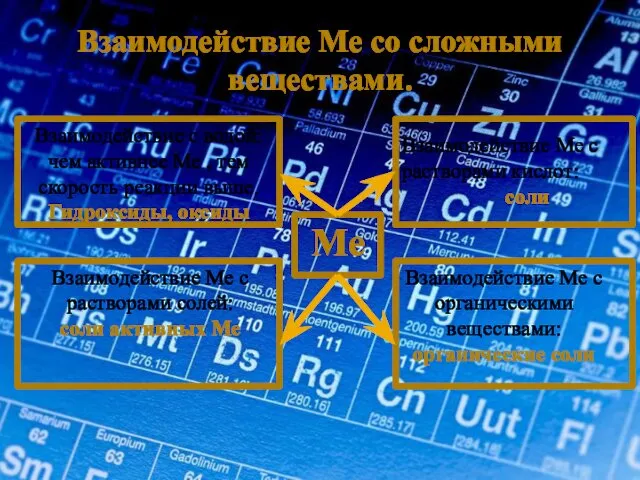
- 15. Взаимодействие Ме со сложными веществами. Ме Взаимодействие с водой: чем активнее Ме , тем скорость реакции
- 16. Проверь себя На основании положения металлов в электрохимическом ряду напряжений обоснуйте возможность протекания следующих химических реакций:
- 18. Скачать презентацию

![Главные особенности элементов металлов. Малое число валентных электронов ( [1-3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52259/slide-2.jpg)








 Вывод формул для расчета современной (текущей) стоимости обычной ренты (постнумерандо). (Тема 5.4)
Вывод формул для расчета современной (текущей) стоимости обычной ренты (постнумерандо). (Тема 5.4) Термическая обработка сварных изделий
Термическая обработка сварных изделий Презентация Мы и наше здоровье
Презентация Мы и наше здоровье Россия – многонациональная культура
Россия – многонациональная культура Возбудитель сибирской язвы
Возбудитель сибирской язвы Происхождение банков и развитие банковского дела
Происхождение банков и развитие банковского дела Презентация диплом НАК лемачко версия2
Презентация диплом НАК лемачко версия2 Порушення прав у казці
Порушення прав у казці Презентация Герои войны - кто они?
Презентация Герои войны - кто они? Презентация рабочей программы Валеологическое воспитание дошкольников
Презентация рабочей программы Валеологическое воспитание дошкольников Трудовое право
Трудовое право Здоровьесберегающие технологии для детей с ОНР
Здоровьесберегающие технологии для детей с ОНР Архитектурные шрифты. Правила построения
Архитектурные шрифты. Правила построения Архитектура микропроцессора
Архитектура микропроцессора Задание на дизайн-проект квартиры
Задание на дизайн-проект квартиры Периферийные устройства. Мониторы
Периферийные устройства. Мониторы Обязательное страхование автогражданской ответственности (ОСАГО)
Обязательное страхование автогражданской ответственности (ОСАГО) Экологический проект 2016/2017 года. Начальная школа
Экологический проект 2016/2017 года. Начальная школа Основные положения молекулярно-кинетической теории. (10 класс)
Основные положения молекулярно-кинетической теории. (10 класс) Отчет по теме самообразования: Развитие творческих способностей воспитателя через ознакомление детей с русским народным творчеством
Отчет по теме самообразования: Развитие творческих способностей воспитателя через ознакомление детей с русским народным творчеством Описание технологического процесса приготовления палтуса в зеленом соусе, пирожков печеных с капустным фаршем
Описание технологического процесса приготовления палтуса в зеленом соусе, пирожков печеных с капустным фаршем Ветераны школы №1
Ветераны школы №1 Методическая разработка урока географии в 7 классе Географическое положение Африки. История открытия и исследования материка
Методическая разработка урока географии в 7 классе Географическое положение Африки. История открытия и исследования материка El participio pasado. El pretérito perfecto de indicativo
El participio pasado. El pretérito perfecto de indicativo Конспект урока географии в 6 классе Землетрясения: причины и последствия
Конспект урока географии в 6 классе Землетрясения: причины и последствия Интеллектуальный лабиринт Увлекательный мир химии
Интеллектуальный лабиринт Увлекательный мир химии Опыт подготовки к ЕГЭ на примере заданий по истории Великой Отечественной войны
Опыт подготовки к ЕГЭ на примере заданий по истории Великой Отечественной войны Важные навыки в работе. Предметы и профессии
Важные навыки в работе. Предметы и профессии