Содержание
- 2. План лекции Марганец. Строение атома, степени окисления. Кислотно-основные свойства. Окислительно-восстановительные свойства соединений марганца. Поведение перманганата калия
- 3. 1. Марганец. Строение атома, степени окисления. Кислотно-основные свойства 0 +2 +4 +6 +7 Mn MnO MnO2
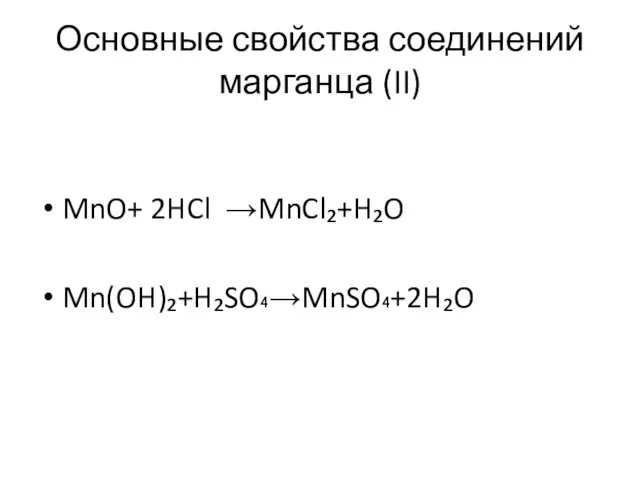
- 4. Основные свойства соединений марганца (II) MnO+ 2HCl →MnCl₂+H₂O Mn(OH)₂+H₂SO₄→MnSO₄+2H₂O
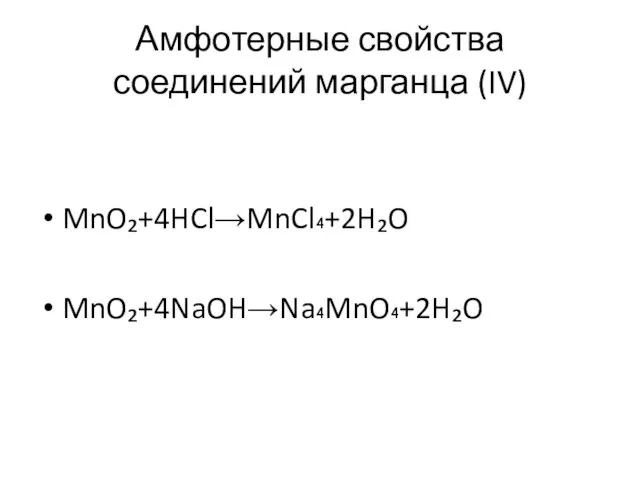
- 5. Амфотерные свойства соединений марганца (IV) MnO₂+4HCl→MnCl₄+2H₂O MnO₂+4NaOH→Na₄MnO₄+2H₂O
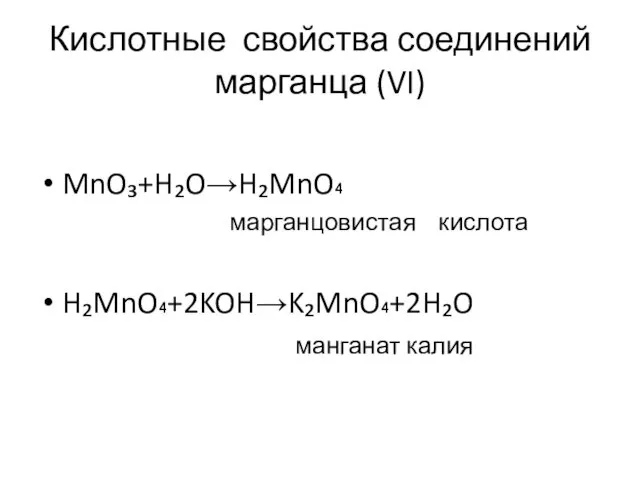
- 6. Кислотные свойства соединений марганца (VI) MnO₃+H₂O→H₂MnO₄ марганцовистая кислота H₂MnO₄+2KOH→K₂MnO₄+2H₂O манганат калия
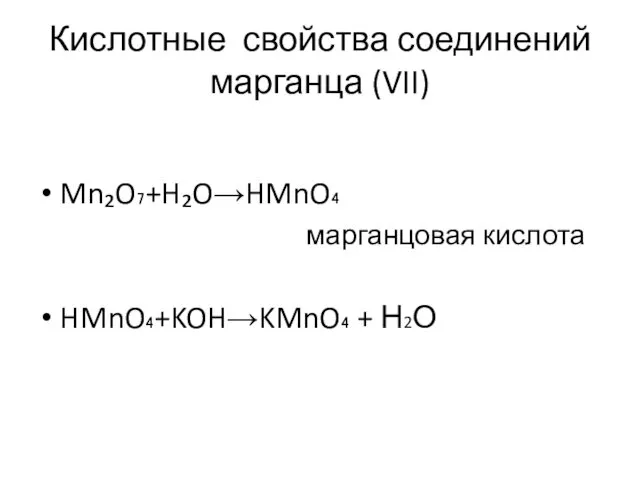
- 7. Кислотные свойства соединений марганца (VII) Mn₂O₇+H₂O→HMnO₄ марганцовая кислота HMnO₄+KOH→KMnO₄ + Н2О
- 8. 2. Окислительно-восстановительные свойства соединений марганца 0 +2 +4 +6 +7 Mn MnO MnO2 MnО3 Mn2О7 Mn(OH)2
- 9. Восстановительные свойства соединений марганца(II) 2MnO+O₂→2MnO₂ Mn -2е →Mn 2 O₂ +4е →2O 1 -2 +4 +2
- 10. ОВД соединений марганца (IV) 2MnO₂+O₂→2MnO₃ MnO₂+Si→Mn+SiO₂ +4 +6 +4 0 Вос-ль ок-ль
- 11. ОВД соединений марганца (VI) 3K₂MnO₄+2H₂O→MnO₂+2KMnO₄+4KO₄ +6 +4 +7
- 12. Окислительные свойства соединений марганца(VII) KMnO₄ -всегда окислитель, т.к у Mn-мах степень окисления. В зависимости от среды
- 13. Поведение перманганата калия в различных средах KMnO4 – всегда окислитель. Его восстановление зависит от среды: H+
- 14. а) кислая среда 2KMnO₄ + 5Na₂SO₃ +3H₂SO₄→2MnSO₄ + 5Na₂SO₄ + K ₂SO₄ +H₂O Ок-ль MnO₄⁻ +
- 15. б)Нейтральная среда 2KMnO₄ + 3Na₂SO₃ + H₂O →2 MnO₂ + 3Na₂SO₄ + 2KOH Ок-ль MnO₄ +
- 16. в) щелочная среда 2KMnO₄ + Na₂SO₃ + 2 KOH → 2 K₂MnO₄ + Na₂SO₄ + H₂O
- 17. 3.Биологическое значение марганца Марганец – это микроэлемент, который содержится в организмах растений, животных и человека. В
- 19. Скачать презентацию












 School uniform. Clothes for parties. Casual wear
School uniform. Clothes for parties. Casual wear Покрытия с плоскими несущими конструкциями
Покрытия с плоскими несущими конструкциями Презентация Химические загадки
Презентация Химические загадки Призывайте Божью благодать
Призывайте Божью благодать Характеристика поражений хирургического профиля, особенности хирургической тактики и лечение в ЧС мирного и военного времени
Характеристика поражений хирургического профиля, особенности хирургической тактики и лечение в ЧС мирного и военного времени Презентация к логопедическому занятию в подготовительной группе по теме Ранняя весна.
Презентация к логопедическому занятию в подготовительной группе по теме Ранняя весна. Законы будущего
Законы будущего Подготовка к ГИА по химии
Подготовка к ГИА по химии День Матери России
День Матери России Трофобластическая болезнь. Клиника. Диагностика
Трофобластическая болезнь. Клиника. Диагностика Методический семинар
Методический семинар Мобильные приложения для ресторанов
Мобильные приложения для ресторанов Федеративная Республика Германия
Федеративная Республика Германия Презентация программного продукта VirtualBox
Презентация программного продукта VirtualBox учебное занятие для младшего школьного возраста по теме Мир бумаги
учебное занятие для младшего школьного возраста по теме Мир бумаги Вакуумные выключатели
Вакуумные выключатели Строительство школ и детсадов в Пермском крае
Строительство школ и детсадов в Пермском крае Культура бароко
Культура бароко Интегрированное внеклассное мероприятие Полет в космос
Интегрированное внеклассное мероприятие Полет в космос Вятский край. Видные люди Вятской земли.
Вятский край. Видные люди Вятской земли. Федеральный стандарт оценки ФСО-9. Оценка для целей залога
Федеральный стандарт оценки ФСО-9. Оценка для целей залога Обучение по продукту фиксированной связи МТС сентябрь 2014
Обучение по продукту фиксированной связи МТС сентябрь 2014 Морфология микроорганизмов
Морфология микроорганизмов Память в веках
Память в веках Учет и аудит наличия, движения и использования материально-производственных запасов в СПК (колхоз) имени Куйбышева Кинельского района
Учет и аудит наличия, движения и использования материально-производственных запасов в СПК (колхоз) имени Куйбышева Кинельского района Контроллеры для систем вентиляции и кондиционирования
Контроллеры для систем вентиляции и кондиционирования свойства и способы получения солей
свойства и способы получения солей Технические средства нанотехнологий. Диагностика и методы исследования нанообъектов и наносистем
Технические средства нанотехнологий. Диагностика и методы исследования нанообъектов и наносистем