Содержание
- 2. Содержание 1. Цели и задачи 2. Задача № 1 « Получение и свойства гидроксида алюминия »
- 3. Цели и задачи Образовательные задачи: Формирование теоретических навыков и умений учащихся для выполнения лабораторных опытов, практической
- 4. Задача №1. « Получение и свойства гидроксида алюминия » Задание: получить гидроксид алюминия и доказать его
- 5. Решение задачи №1 AlCl3 NaOH Al(OH)3 Na[Al(OH)4] NaOH №1 №2 1) AlCl3 + 3NaOH -> Al(OH)3
- 6. Задача №2. Цепочка превращений « Железо и его соединения » Задание к задаче №2 Решить цепочку
- 7. Решение задачи №2 «Железо и его соединения» Fe -> FeCl2 -> Fe(OH)2 -> Fe(OH)3 -> FeCl3
- 8. Задача №3. Качественное определение иодида калия и гидроксида кальция Задание к задаче №3 В пробирках №1
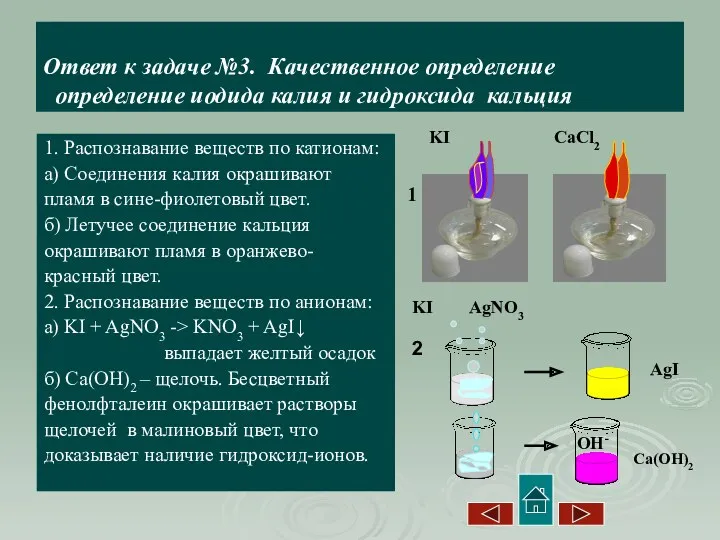
- 9. Ответ к задаче №3. Качественное определение определение иодида калия и гидроксида кальция 1. Распознавание веществ по
- 10. Задача №4. Вытеснение металлов из растворов солей Задание В пробирках № 1,2 находятся растворы сульфата железа
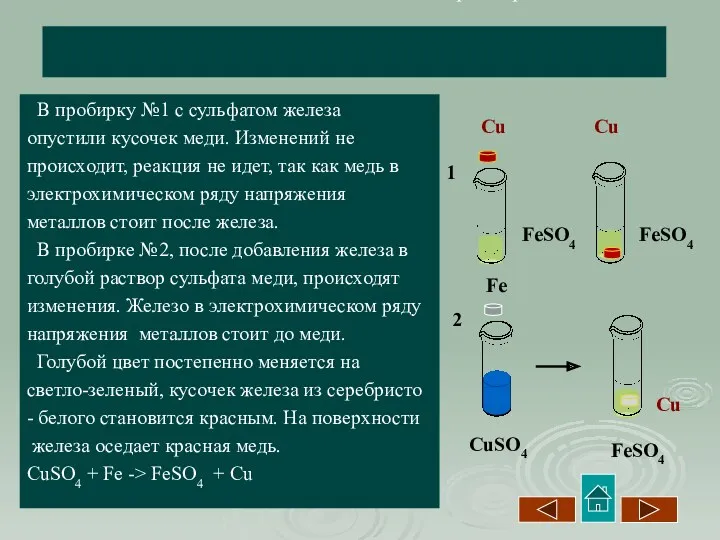
- 11. Решение к задаче №4. Вытеснение металлов из растворов солей. В пробирку №1 с сульфатом железа опустили
- 12. HCl Вместо точек вставить формулы, слово. 1. Амфотерный оксид и гидроксид ……. , ……….. 2. Для
- 13. Проверь свои знания. Тест №2 Вместо точек вставить формулы, в 5-м вопросе вставить коэффициент перед формулой
- 14. Вместо точек вставить слова и формулы. 1) Соединения калия окрашивают пламя в ………………… цвет. 2) Летучее
- 15. Тест №4. Проверь свои знания. Вместо точек вставить слова и формулы 1) С каким из металлов
- 16. Контроль знаний Тест №1 1. Гидроксид алюминия взаимодействует с : а) H2O б) CO2, в) H2SO4
- 17. Контроль знаний № 2, 3. Тест № 2 1. Хлорид железа (II) образуется при взаимодействии железа
- 18. Контроль знаний №4 1. Железо можно вытеснить из растворов солей следующими парами металлов: а) Na, Ca,
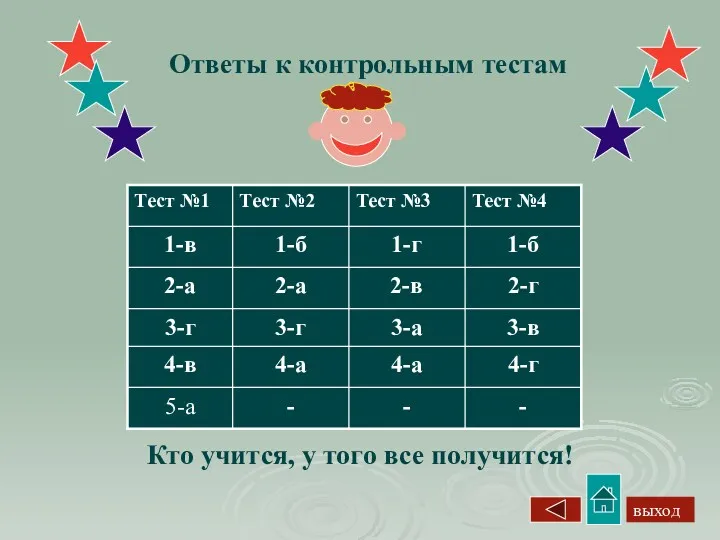
- 19. Ответы к контрольным тестам Кто учится, у того все получится! выход
- 20. «Краски лета, буйство лета! Приукрасила природа волшебством себя и цветом: красным,синим и зеленым! Объясни все это
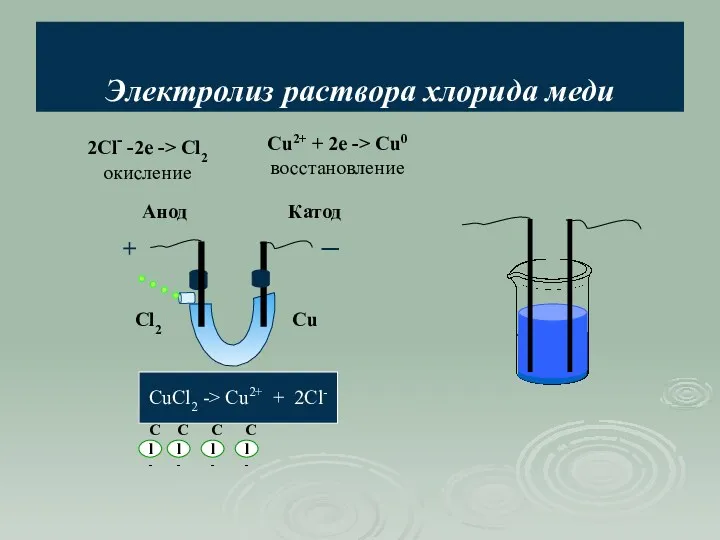
- 21. Электролиз раствора хлорида меди + ─ Анод Катод CuCl2 -> Cu2+ + 2Cl- Cl2 Cu 2Cl-
- 23. Скачать презентацию



![Решение задачи №1 AlCl3 NaOH Al(OH)3 Na[Al(OH)4] NaOH №1 №2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/476966/slide-4.jpg)












 Кинолента жизни. К 60-летию главного архитектора города Виталия Перцева.
Кинолента жизни. К 60-летию главного архитектора города Виталия Перцева. Изучение английского языка с помощью фильмов и сериалов
Изучение английского языка с помощью фильмов и сериалов Полимеразная цепная реакция
Полимеразная цепная реакция Фирменный стиль в презентациях
Фирменный стиль в презентациях Правила поведения и меры безопасности на льду в осенне-зимний период
Правила поведения и меры безопасности на льду в осенне-зимний период Развитие навыков копирайтинга с использованием русских неологизмов английского происхождения
Развитие навыков копирайтинга с использованием русских неологизмов английского происхождения Префектура Юго-Западного административного округа Управа района Зюзино. Благоустройство территорий
Префектура Юго-Западного административного округа Управа района Зюзино. Благоустройство территорий Религиозные традиции. Урок 11
Религиозные традиции. Урок 11 Фарфор и его использование
Фарфор и его использование Основы исламской культуры(основы мировых религиозных культур)
Основы исламской культуры(основы мировых религиозных культур) Афиша презентация к уроку ИЗО в 3классе
Афиша презентация к уроку ИЗО в 3классе Бактериофагия, бактериофаги
Бактериофагия, бактериофаги Приведение параметров обмотки ротора к обмотке статора асинхронной машины. Векторная диаграмма асинхронного двигателя
Приведение параметров обмотки ротора к обмотке статора асинхронной машины. Векторная диаграмма асинхронного двигателя Эпоха Возрождения
Эпоха Возрождения Принципы работы блоков и модулей MES
Принципы работы блоков и модулей MES Пропедевтика. Аускультация сердца
Пропедевтика. Аускультация сердца День космонавтики. Игра-викторина для учащихся 7-9 классов
День космонавтики. Игра-викторина для учащихся 7-9 классов Вирусные заболевания кожи
Вирусные заболевания кожи Чебурашка изучает компьютер
Чебурашка изучает компьютер Тесты в программе Power Point
Тесты в программе Power Point Рациональная отработка долот. Системы кодировки износа шарошечных долот и PDC. Семинар 3
Рациональная отработка долот. Системы кодировки износа шарошечных долот и PDC. Семинар 3 Работы по шумоизоляции, вентиляции
Работы по шумоизоляции, вентиляции Социальная антропология
Социальная антропология Нетрадиционные методы в логопедии.
Нетрадиционные методы в логопедии. Состав чисел 11, 12, 13. Игра - тренажёр 1 класс
Состав чисел 11, 12, 13. Игра - тренажёр 1 класс Медициналық қызметтің сапасын сараптауды ұйымдастыру және жүргізу ережесі
Медициналық қызметтің сапасын сараптауды ұйымдастыру және жүргізу ережесі Державна інноваційна фінансово-кредитна установа (ДІФКУ)
Державна інноваційна фінансово-кредитна установа (ДІФКУ) Математический диктант
Математический диктант