Содержание
- 2. 1 Задание Азот в природе встречается в виде соединения Mg3N2 KNO3 NH3 KNO2 Далее 1 бал.
- 3. 2 Задание Содержание азота по объему в воздухе составляет 21% 23% 78% 75% Далее 1 бал.
- 4. 3 Задание Элемент проявляет в соединениях максимальную степень окисления +5. Какую конфигурацию валентных электронов может иметь
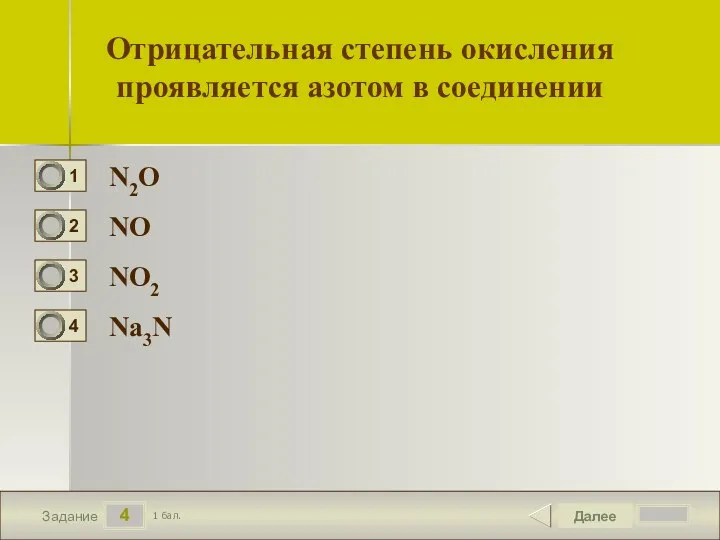
- 5. 4 Задание Отрицательная степень окисления проявляется азотом в соединении N2O NO NO2 Na3N Далее 1 бал.
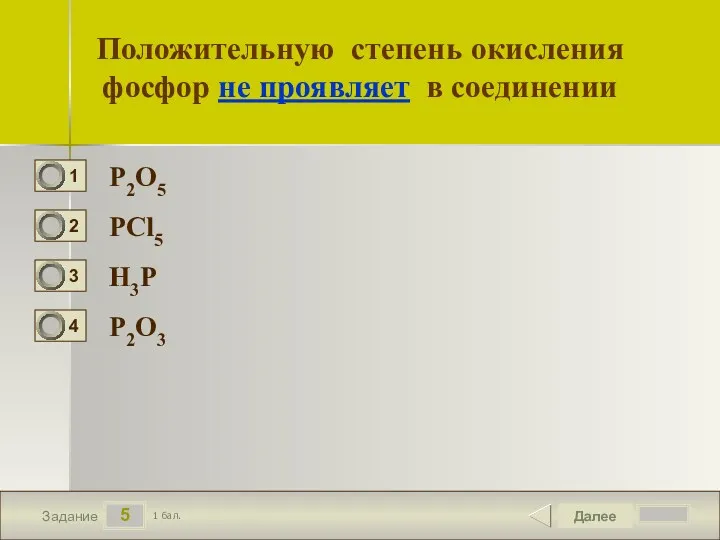
- 6. 5 Задание Положительную степень окисления фосфор не проявляет в соединении P2O5 PCl5 H3P P2O3 Далее 1
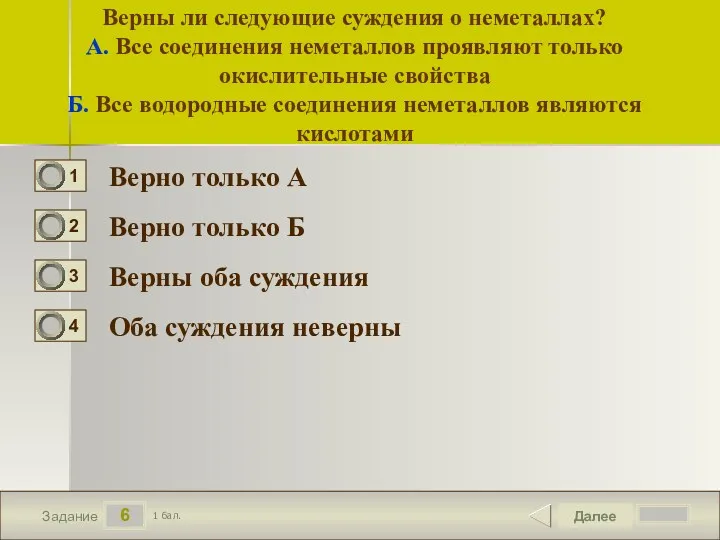
- 7. 6 Задание Верны ли следующие суждения о неметаллах? А. Все соединения неметаллов проявляют только окислительные свойства
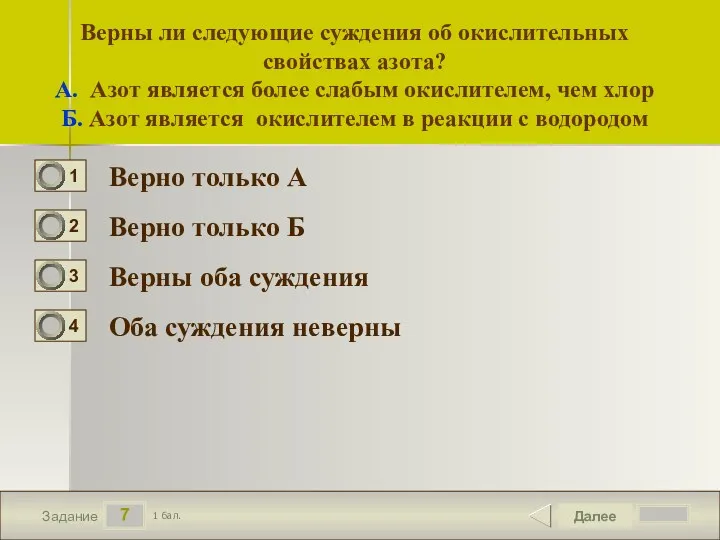
- 8. 7 Задание Верны ли следующие суждения об окислительных свойствах азота? А. Азот является более слабым окислителем,
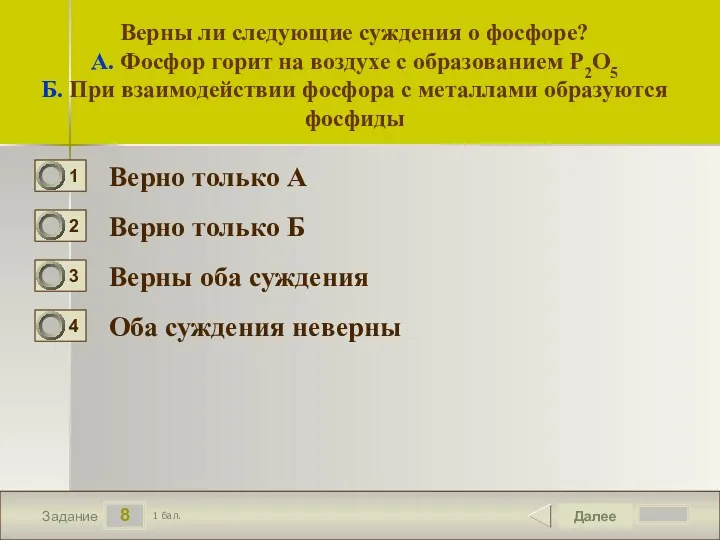
- 9. 8 Задание Верны ли следующие суждения о фосфоре? А. Фосфор горит на воздухе с образованием P2O5
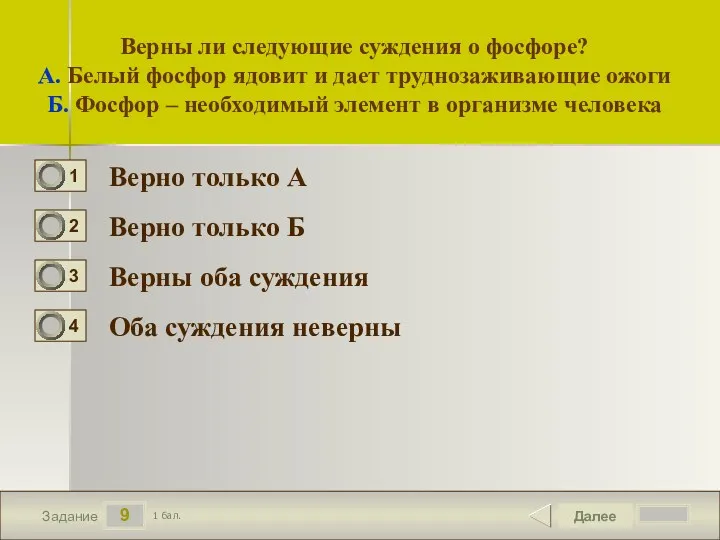
- 10. 9 Задание Верны ли следующие суждения о фосфоре? А. Белый фосфор ядовит и дает труднозаживающие ожоги
- 11. 10 Задание Оксид фосфора (V) не реагирует с Водой Хлоридом натрия Гидроксидом натрия Оксидом кальция Далее
- 12. 11 Задание Устойчивость водородных соединений в ряду NH3 –PH3 –AsH3 – SbH3 - BiH3 Возрастает Уменьшается
- 13. 12 Задание С ростом порядкового номера элемента кислотные свойства оксидов N2O3 - P2O3 - As2O3 -
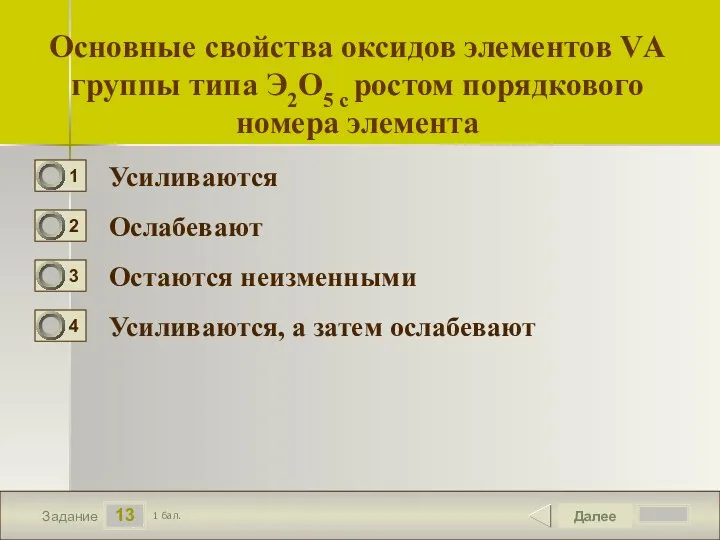
- 14. 13 Задание Основные свойства оксидов элементов VА группы типа Э2О5 с ростом порядкового номера элемента Усиливаются
- 15. 14 Задание Аммиак при нормальных условиях - это Бесцветный газ без запаха Газ с резким запахом
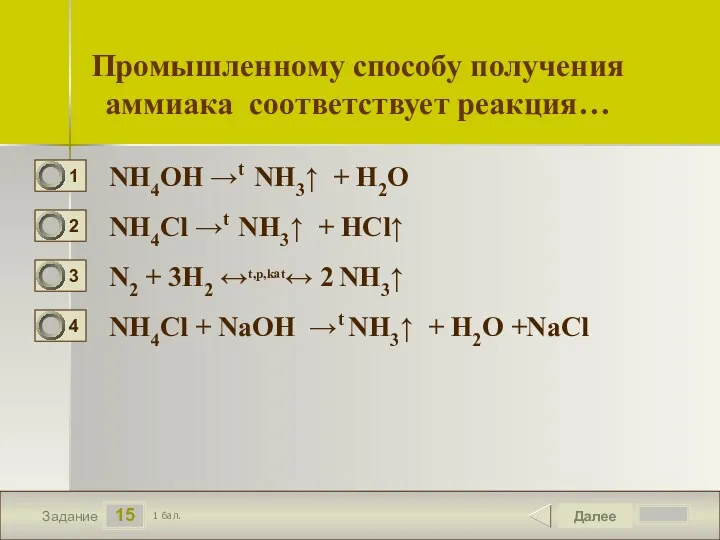
- 16. 15 Задание Промышленному способу получения аммиака соответствует реакция… NH4OH →t NH3↑ + H2O NH4Cl →t NH3↑
- 17. 16 Задание Валентность и степень окисления атома азота в хлориде аммония соответственно равны ІІІ и -3
- 18. 17 Задание Относиться к довольно слабым электролитам Разлагается при хранении и нагревании Растворяет Au, Pt, W
- 19. 18 Задание Сильная Взаимодействует с основными и амфотерными оксидами «Растворяет» цинк При взаимодействии с металлами не
- 20. 19 Задание NO2 NO N2O NН3 Далее 1 бал. Взаимодействие медной стружки с концентрированной азотной кислотой
- 21. 20 Задание Выберите все правильные ответы! Азотная кислота Бесцветная жидкость с резким удушливым запахом Сильный электролит
- 22. 21 Задание Выберите все правильные ответы! Аммиак Бесцветная жидкость с резким удушливым запахом Cильный восстановитель Cильный
- 23. NH4NO2 KNO3 Hg(NO3)2 22 Задание Укажите все правильные позиции! Установите соответствие между формулой нитрата и газообразным(ми)
- 25. Скачать презентацию














 Мир растений. Лекарственные растения
Мир растений. Лекарственные растения Пости централізації, кросовий монтаж і технічне обслуговування станційних пристроїв
Пости централізації, кросовий монтаж і технічне обслуговування станційних пристроїв Салық – мемлекеттік бюджетке заңды және жеке тұлғалардан белгілі бір мөлшерде түсетін міндетті
Салық – мемлекеттік бюджетке заңды және жеке тұлғалардан белгілі бір мөлшерде түсетін міндетті Технология ручной дуговой сварки неплавящимся электродом в защитном газе углеродистых сталей, цветных металлов и их сплавов
Технология ручной дуговой сварки неплавящимся электродом в защитном газе углеродистых сталей, цветных металлов и их сплавов Презентация:Использования ИКТ для формирования открытого информационного пространства ДОУ
Презентация:Использования ИКТ для формирования открытого информационного пространства ДОУ Залог успешной работы– это благоприятный психологический климат в классе
Залог успешной работы– это благоприятный психологический климат в классе ФГОС как система обязательных требований.
ФГОС как система обязательных требований. Внутрипартийная борьба в 20-е годы ХХ века в России
Внутрипартийная борьба в 20-е годы ХХ века в России Использование проектной технологии в обучении географии
Использование проектной технологии в обучении географии Праздник праздников, торжество из торжеств
Праздник праздников, торжество из торжеств Автоматизация звука [Р] в середине слова (стечение согласных)
Автоматизация звука [Р] в середине слова (стечение согласных) Бесполое размножение организмов
Бесполое размножение организмов Контрастность изображения
Контрастность изображения Анализ деятельности МОУДОД ЦДТ Созвездие (презентация)
Анализ деятельности МОУДОД ЦДТ Созвездие (презентация) Признаки делимости на 2, 5, 10
Признаки делимости на 2, 5, 10 Город сквозь времена и страны
Город сквозь времена и страны Эхокардиография
Эхокардиография презентация
презентация Запись на программу персонифицированного дополнительного образования
Запись на программу персонифицированного дополнительного образования Проведение дезинфекции в образовательной организации
Проведение дезинфекции в образовательной организации ОБЖ в условиях лета
ОБЖ в условиях лета Презентация Развитие речи Вашего малыша
Презентация Развитие речи Вашего малыша Электронное портфолио педагога-организатора
Электронное портфолио педагога-организатора Использование деятельностного подхода в ОД при формировании ОБЖ
Использование деятельностного подхода в ОД при формировании ОБЖ Тұздау, ашыту және маринадтау әдістері
Тұздау, ашыту және маринадтау әдістері Графика системы matlab. (Лекция 2)
Графика системы matlab. (Лекция 2) diplom (3)
diplom (3) ООПТ Ульяновской области
ООПТ Ульяновской области