Содержание
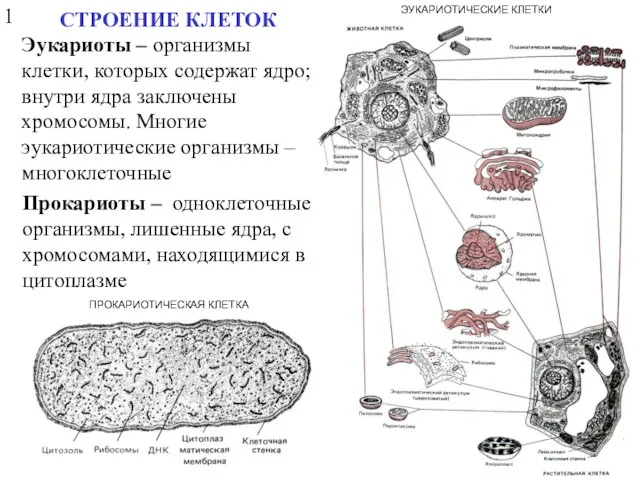
- 4. ПРОКАРИОТИЧЕСКАЯ КЛЕТКА ЭУКАРИОТИЧЕСКИЕ КЛЕТКИ СТРОЕНИЕ КЛЕТОК Эукариоты – организмы клетки, которых содержат ядро; внутри ядра заключены
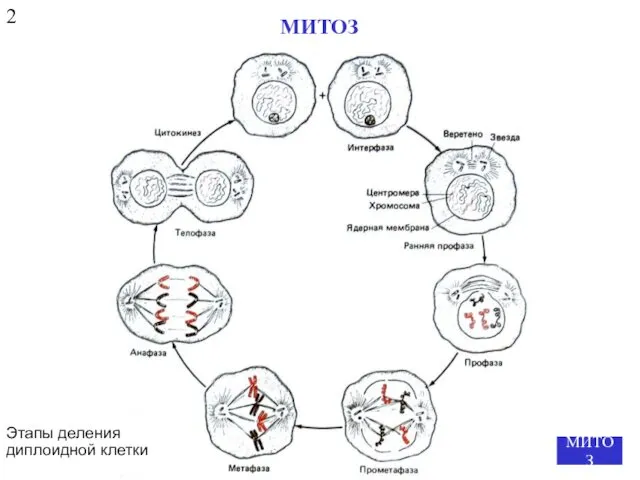
- 5. Этапы деления диплоидной клетки МИТОЗ 2 МИТОЗ
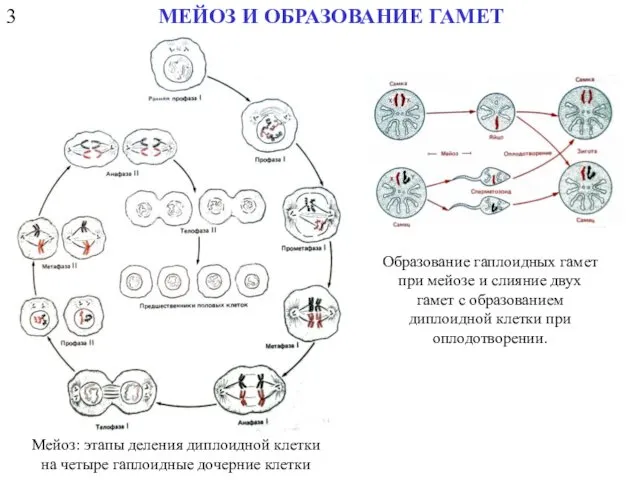
- 6. 3 МЕЙОЗ И ОБРАЗОВАНИЕ ГАМЕТ Мейоз: этапы деления диплоидной клетки на четыре гаплоидные дочерние клетки Образование
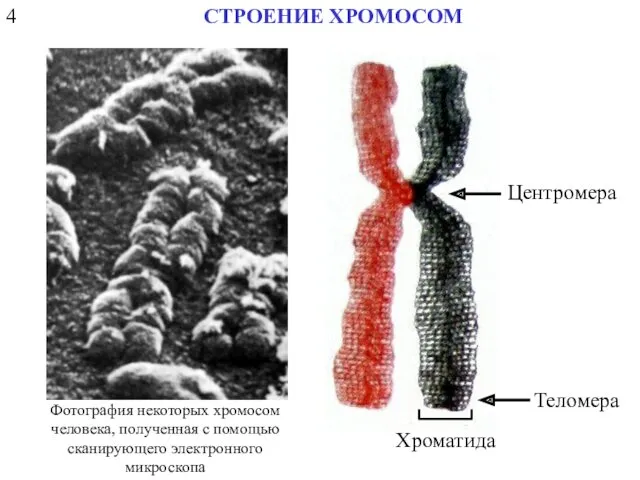
- 7. 4 СТРОЕНИЕ ХРОМОСОМ Центромера Теломера Хроматида Фотография некоторых хромосом человека, полученная с помощью сканирующего электронного микроскопа
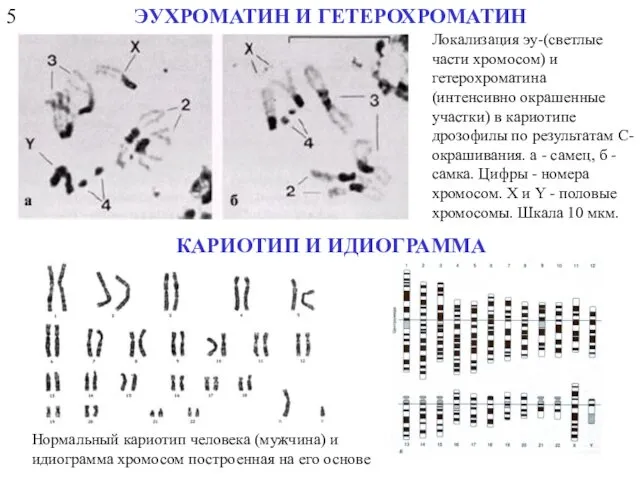
- 8. 5 ЭУХРОМАТИН И ГЕТЕРОХРОМАТИН КАРИОТИП И ИДИОГРАММА Локализация эу-(светлые части хромосом) и гетерохроматина (интенсивно окрашенные участки)
- 9. 6 ГЕН - ХРОМОСОМА - ДНК Грегор Мендель Томас Морган Фридрих Мишер Ген - гипотетическая единица
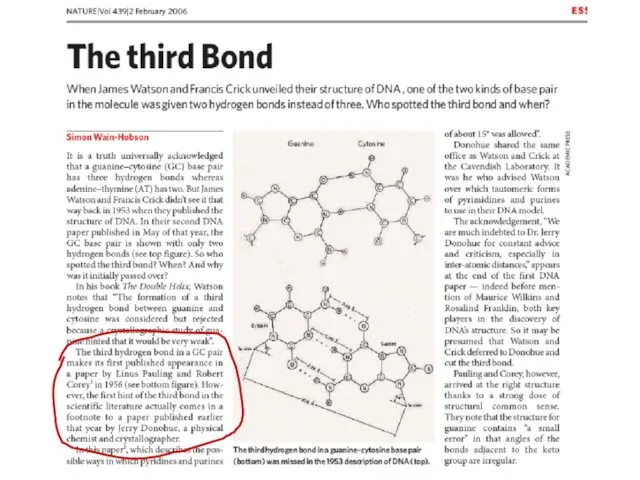
- 10. 7 ХРОНОЛОГИЯ ОТКРЫТИЙ, ПОДГОТОВИВШИХ СОЗДАНИЕ УОТСОНОМ И КРИКОМ МОДЕЛИ ДВОЙНОЙ СПИРАЛИ ДНК 1868 г. Обнаружен нуклеин.
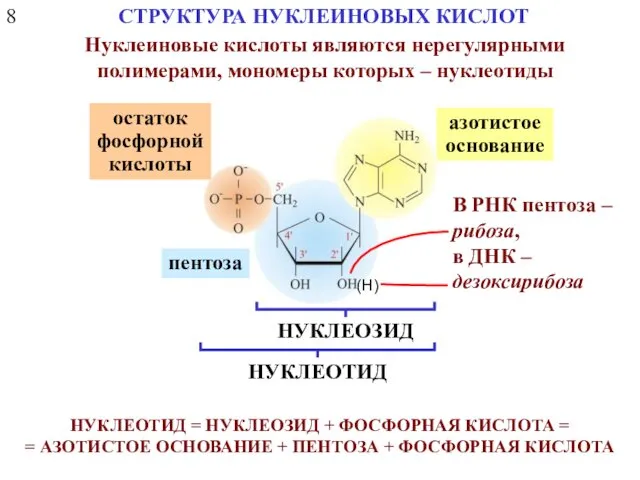
- 11. 8 СТРУКТУРА НУКЛЕИНОВЫХ КИСЛОТ НУКЛЕОТИД = НУКЛЕОЗИД + ФОСФОРНАЯ КИСЛОТА = = АЗОТИСТОЕ ОСНОВАНИЕ + ПЕНТОЗА
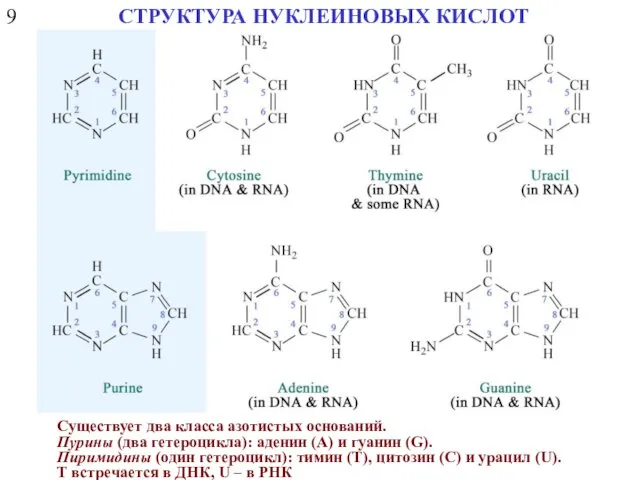
- 12. 9 СТРУКТУРА НУКЛЕИНОВЫХ КИСЛОТ Существует два класса азотистых оснований. Пурины (два гетероцикла): аденин (А) и гуанин
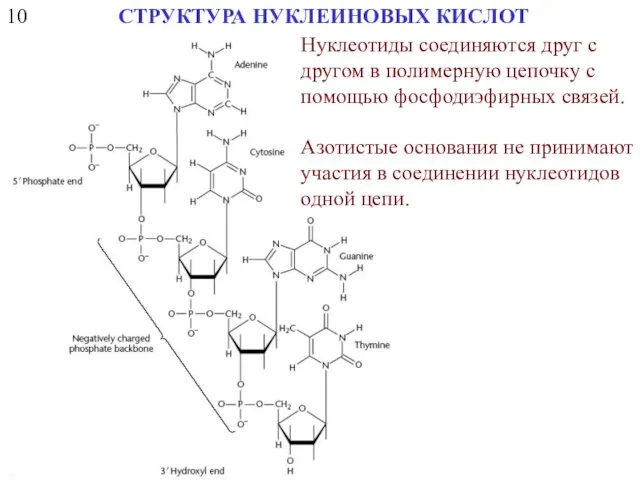
- 13. 10 СТРУКТУРА НУКЛЕИНОВЫХ КИСЛОТ Нуклеотиды соединяются друг с другом в полимерную цепочку с помощью фосфодиэфирных связей.
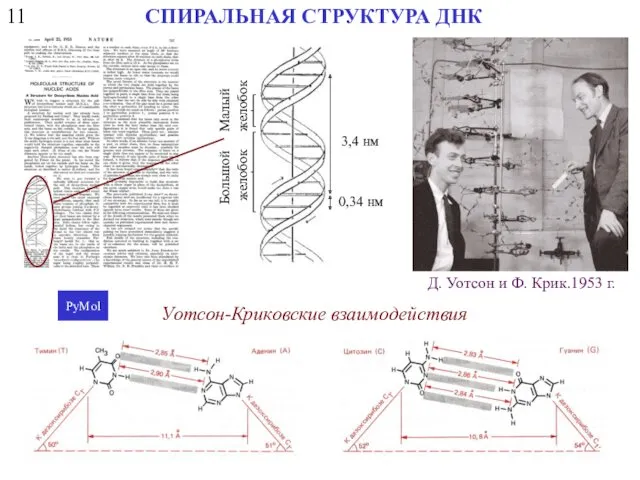
- 14. 11 СПИРАЛЬНАЯ СТРУКТУРА ДНК Малый желобок Большой желобок 3,4 нм 0,34 нм Уотсон-Криковские взаимодействия PyMol Д.
- 16. James Watson Francis Crick
- 17. James Watson Francis Crick
- 18. James Watson Francis Crick
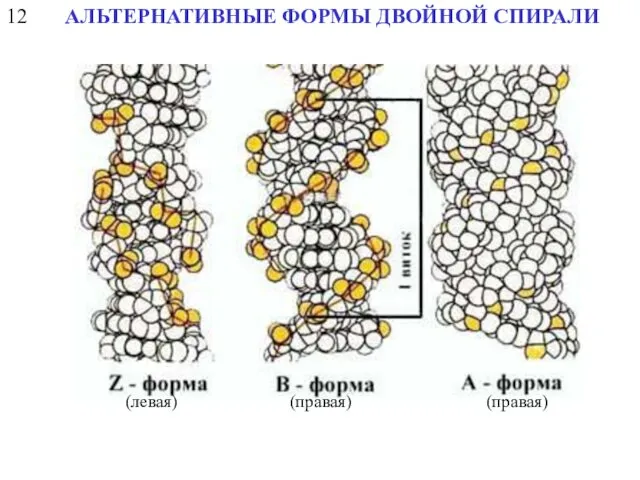
- 19. 12 АЛЬТЕРНАТИВНЫЕ ФОРМЫ ДВОЙНОЙ СПИРАЛИ (левая) (правая) (правая)
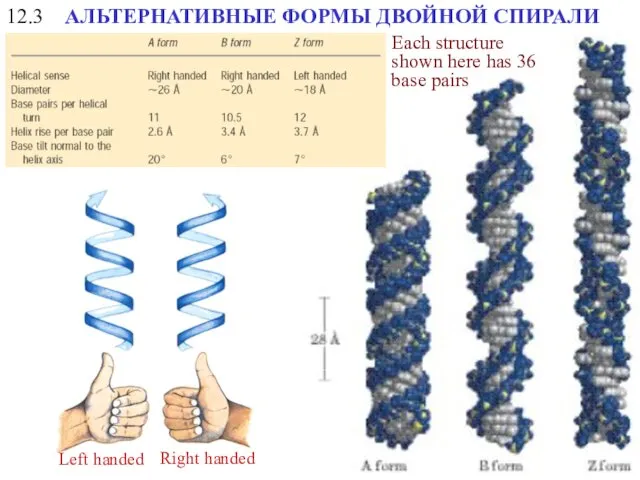
- 20. 12.3 АЛЬТЕРНАТИВНЫЕ ФОРМЫ ДВОЙНОЙ СПИРАЛИ Right handed Left handed Each structure shown here has 36 base
- 21. A form B form Z form Helical sense Right handed Right handed Left handed Diameter 26
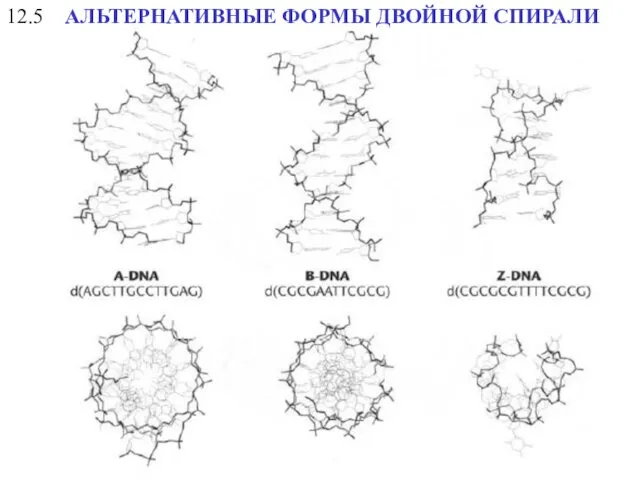
- 22. 12.5 АЛЬТЕРНАТИВНЫЕ ФОРМЫ ДВОЙНОЙ СПИРАЛИ
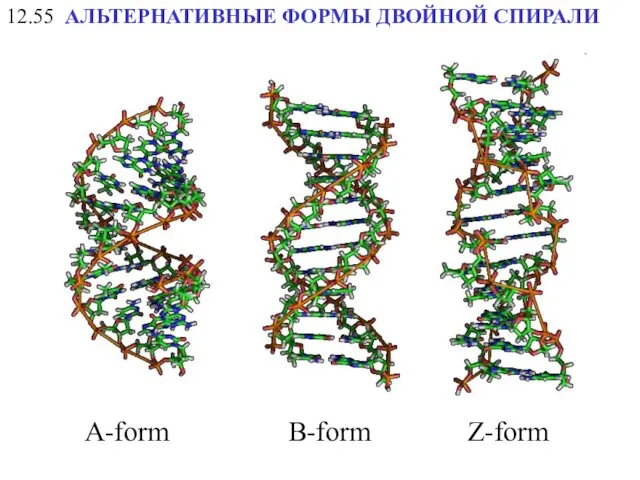
- 23. АЛЬТЕРНАТИВНЫЕ ФОРМЫ ДВОЙНОЙ СПИРАЛИ 12.55 A-form Z-form B-form
- 24. Whether A-DNA occurs in cells is uncertain, but there is evidence for some short stretches (tracts)
- 25. Biological significance of Z-DNA While no definitive biological significance of Z-DNA has been found, it is
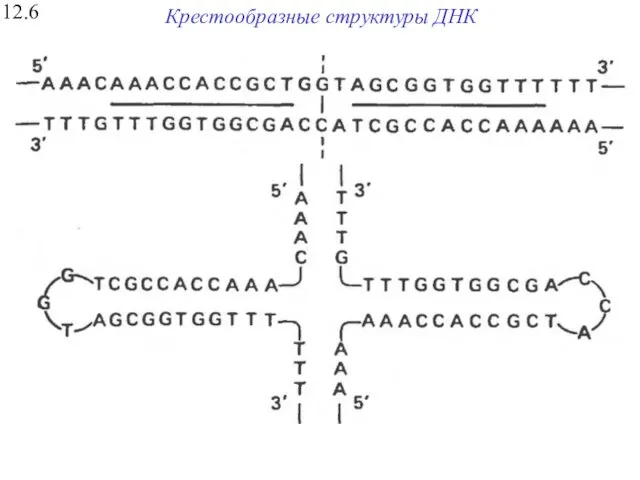
- 26. Крестообразные структуры ДНК 12.6
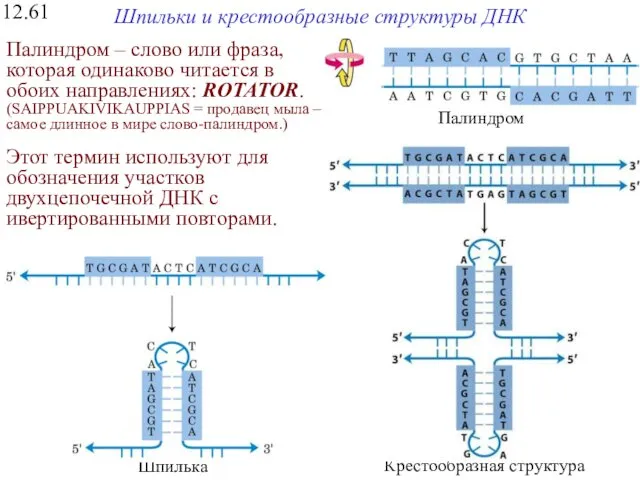
- 27. Шпильки и крестообразные структуры ДНК 12.61 Палиндром – слово или фраза, которая одинаково читается в обоих
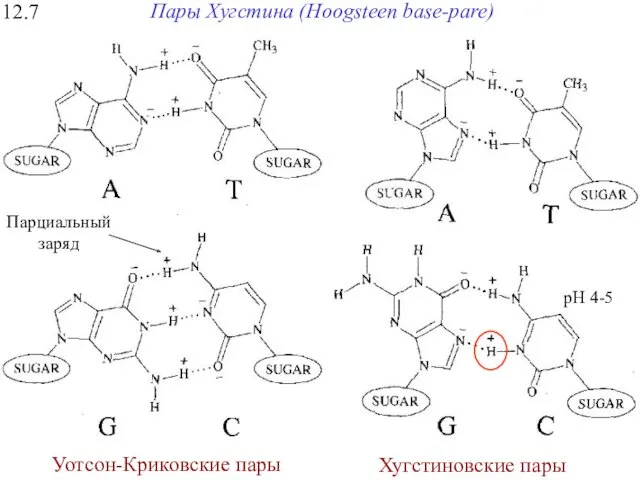
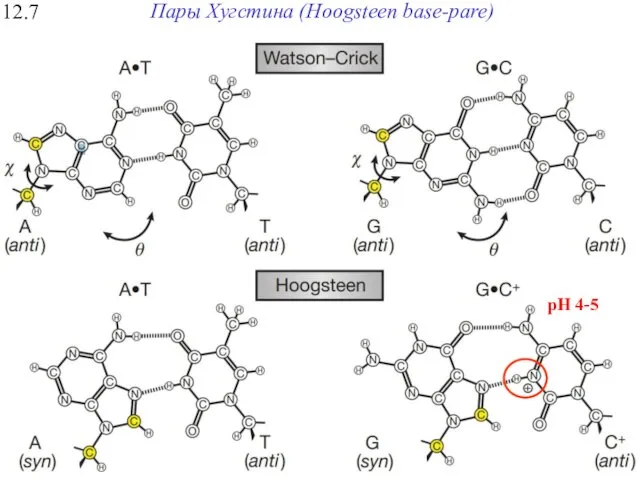
- 28. 12.7 Пары Хугстина (Hoogsteen base-pare) Уотсон-Криковские пары Хугстиновские пары Парциальный заряд pH 4-5
- 29. 12.7 Пары Хугстина (Hoogsteen base-pare) pH 4-5
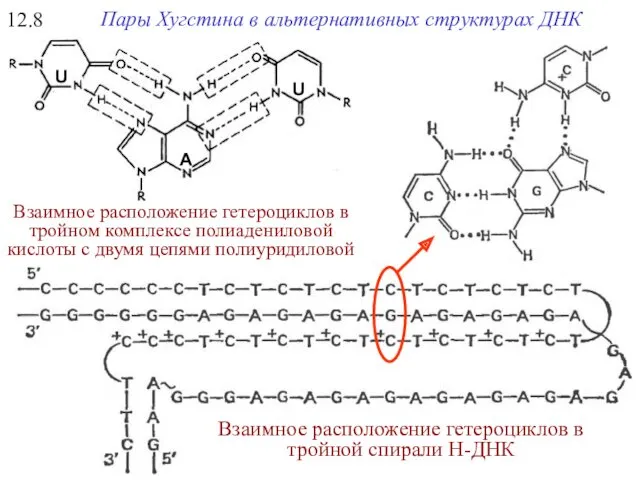
- 30. Взаимное расположение гетероциклов в тройном комплексе полиадениловой кислоты c двумя цепями полиуридиловой 12.8 Пары Хугстина в
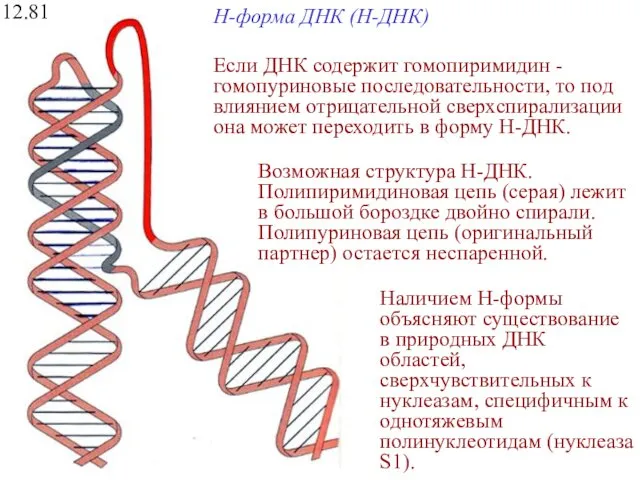
- 31. H-форма ДНК (H-ДНК) 12.81 Возможная структура Н-ДНК. Полипиримидиновая цепь (серая) лежит в большой бороздке двойно спирали.
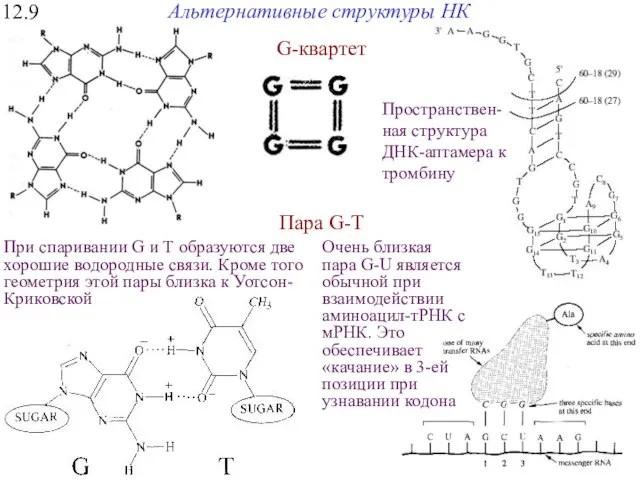
- 32. 12.9 Альтернативные структуры НК G-квартет Пара G-T При спаривании G и Т образуются две хорошие водородные
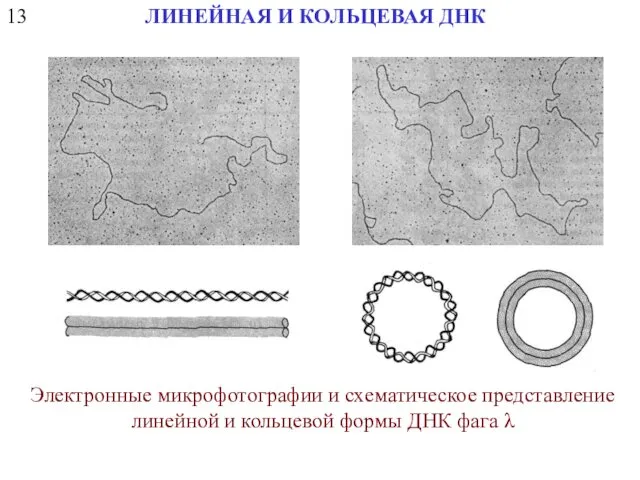
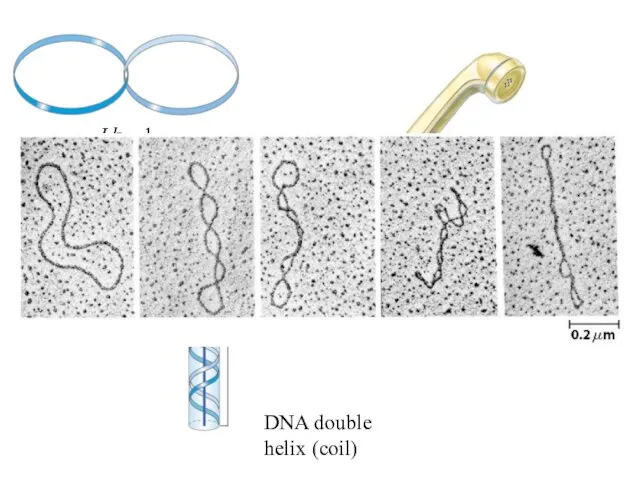
- 33. 13 ЛИНЕЙНАЯ И КОЛЬЦЕВАЯ ДНК Электронные микрофотографии и схематическое представление линейной и кольцевой формы ДНК фага
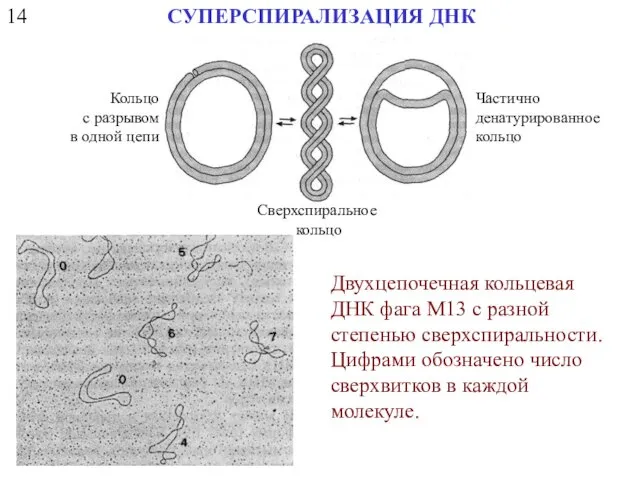
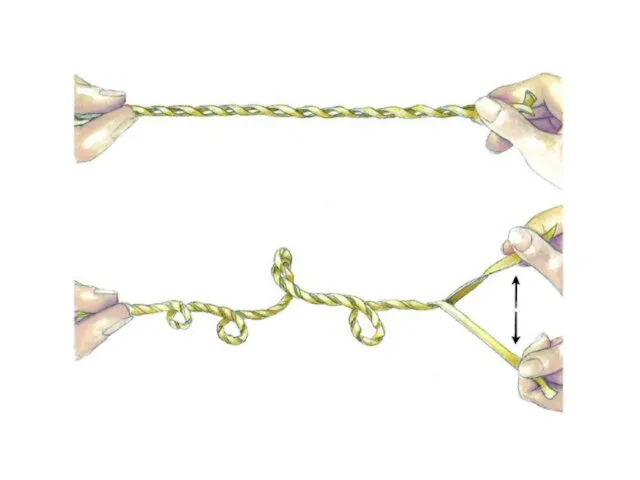
- 34. 14 СУПЕРСПИРАЛИЗАЦИЯ ДНК Кольцо с разрывом в одной цепи Сверхспиральное кольцо Частично денатурированное кольцо Двухцепочечная кольцевая
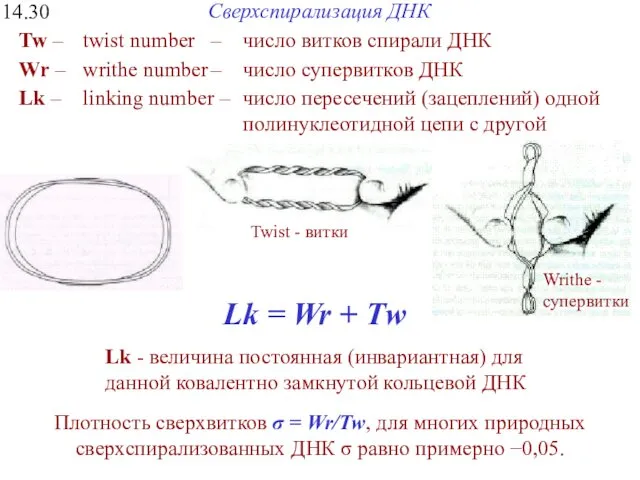
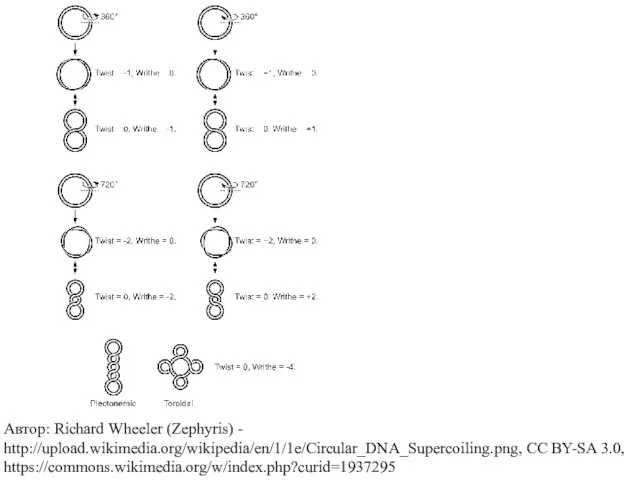
- 35. Сверхспирализация ДНК 14.30 Lk = Wr + Тw Lk - величина постоянная (инвариантная) для данной ковалентно
- 36. Lk = 1 Lk = 6 DNA double helix (coil)
- 38. Автор: Richard Wheeler (Zephyris) - http://upload.wikimedia.org/wikipedia/en/1/1e/Circular_DNA_Supercoiling.png, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=1937295
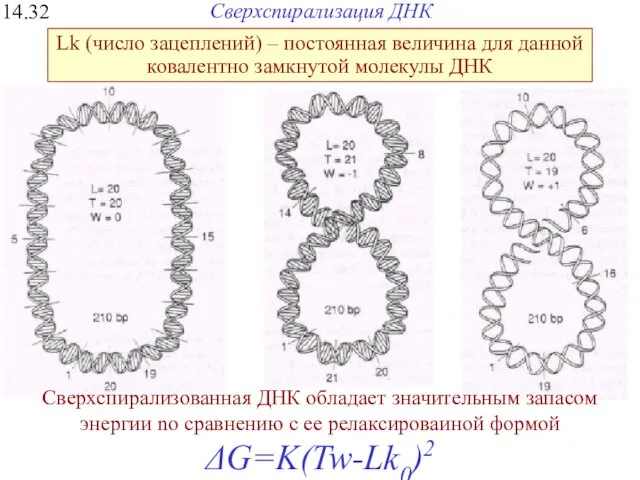
- 39. Сверхспирализация ДНК 14.32 Сверхспирализованная ДНК обладает значитeльным запасом энергии no сравнению с ее релаксироваиной формой ΔG=K(Tw-Lk0)2
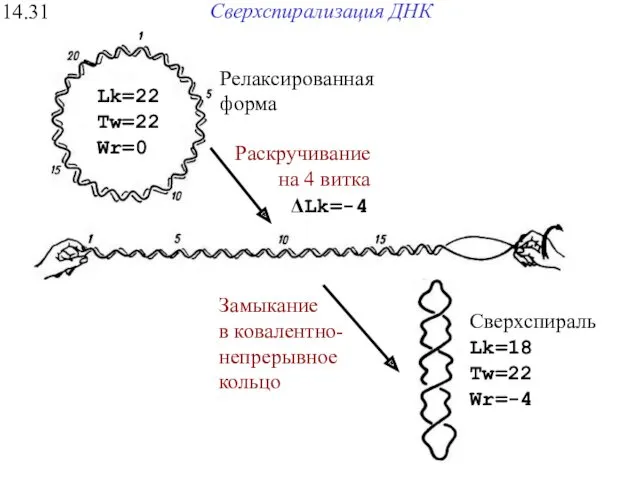
- 40. Сверхспирализация ДНК 14.31 Сверхспираль Lk=18 Tw=22 Wr=-4 Замыкание в ковалентно- непрерывное кольцо Релаксированная форма Раскручивание на
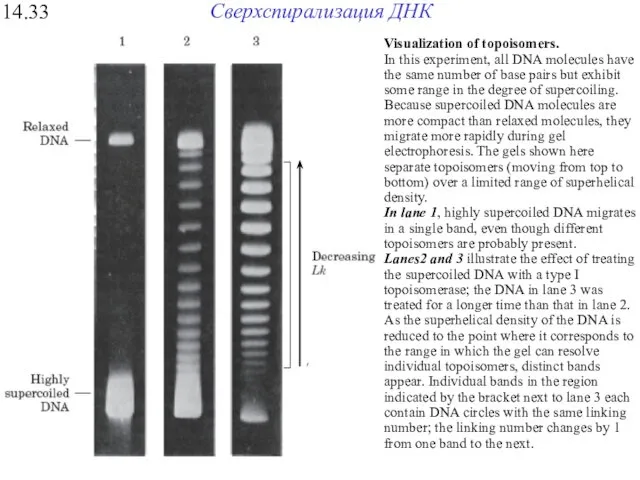
- 41. Сверхспирализация ДНК 14.33 Visualization of topoisomers. In this experiment, all DNA molecules have the same number
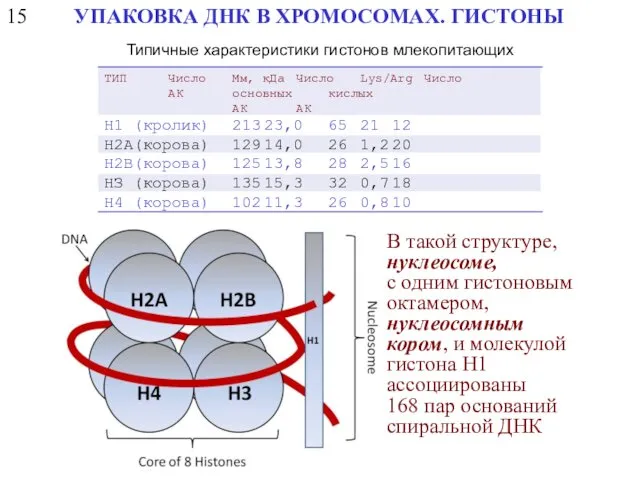
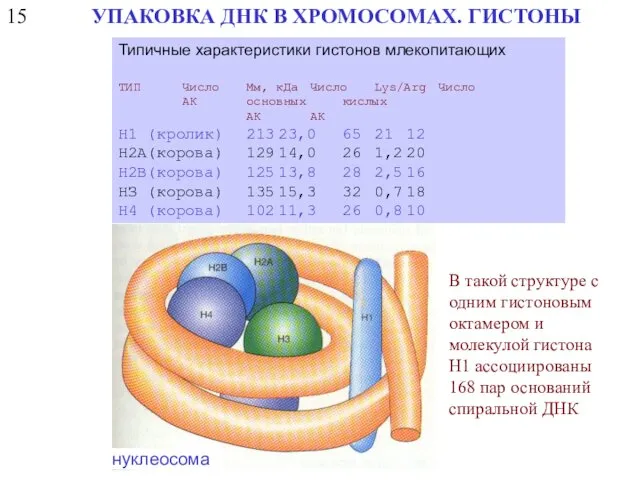
- 42. Типичные характеристики гистонов млекопитающих ТИП Число Мм, кДа Число Lys/Arg Число АК основных кислых АК АК
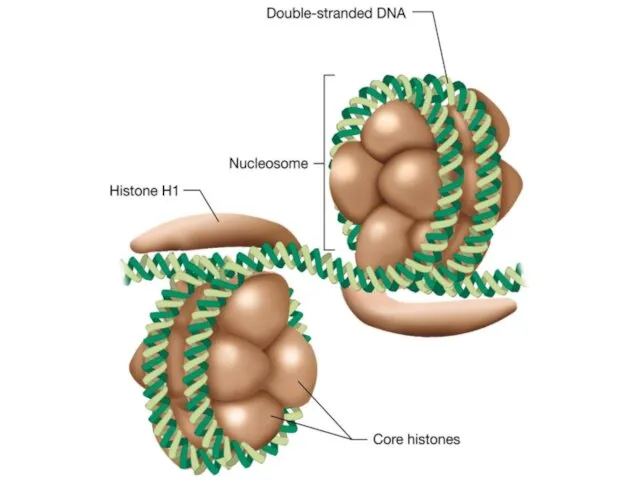
- 44. 15 УПАКОВКА ДНК В ХРОМОСОМАХ. ГИСТОНЫ Типичные характеристики гистонов млекопитающих ТИП Число Мм, кДа Число Lys/Arg
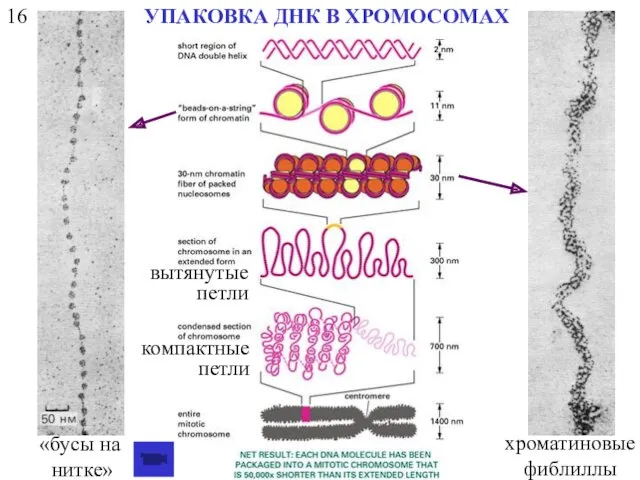
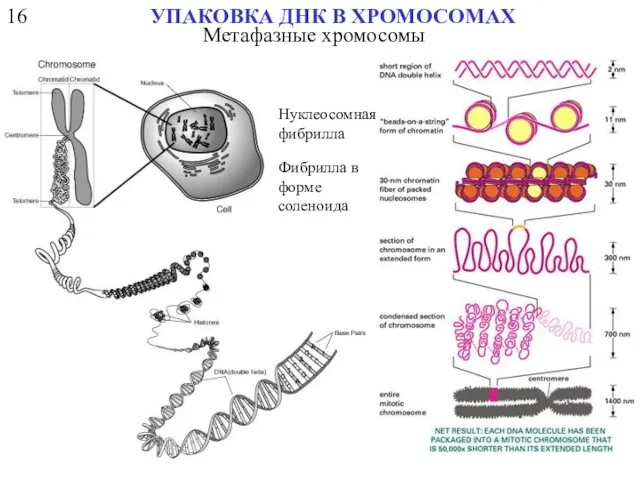
- 45. 16 УПАКОВКА ДНК В ХРОМОСОМАХ «бусы на нитке» хроматиновые фиблиллы вытянутые петли компактные петли
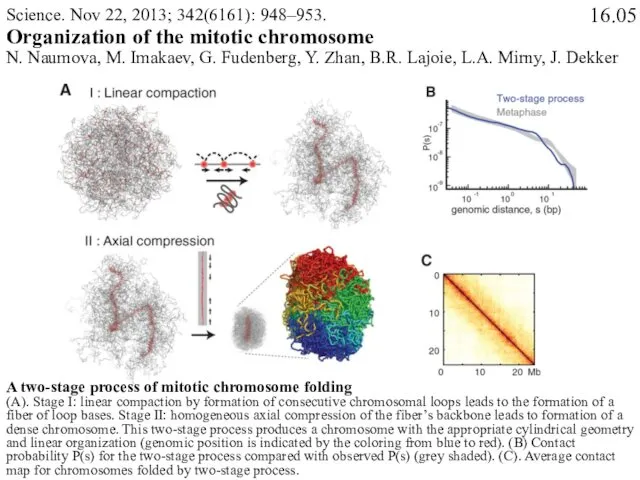
- 47. Science. Nov 22, 2013; 342(6161): 948–953. Organization of the mitotic chromosome N. Naumova, M. Imakaev, G.
- 48. Science. Nov 22, 2013; 342(6161): 948–953. Organization of the mitotic chromosome N. Naumova, M. Imakaev, G.
- 49. Movie M5. Two-step process of mitotic chromosome folding. Four monomers at the base of each loop
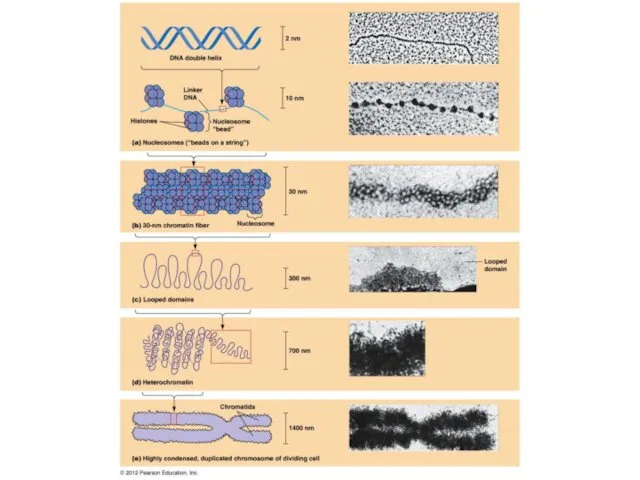
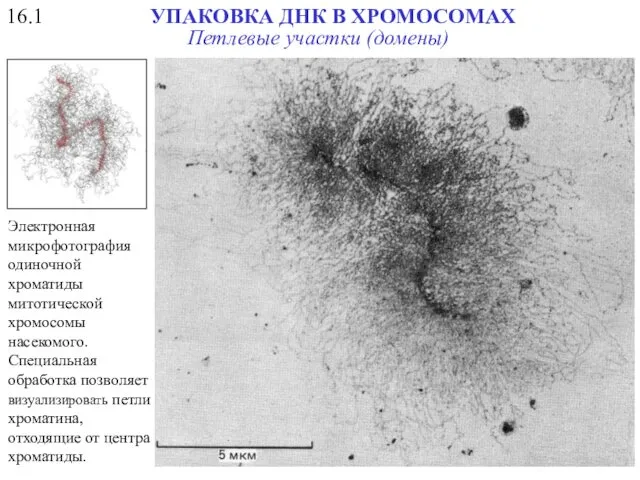
- 50. 16.1 УПАКОВКА ДНК В ХРОМОСОМАХ Электронная микрофотография одиночной хроматиды митотической хромосомы насекомого. Специальная обработка позволяет визуализировать
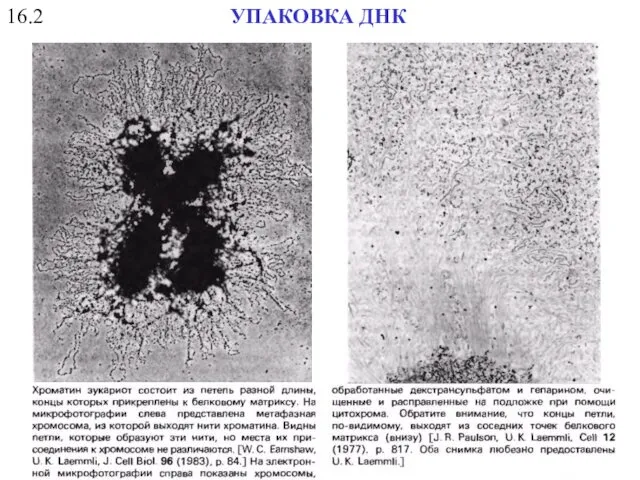
- 51. 16.2 УПАКОВКА ДНК
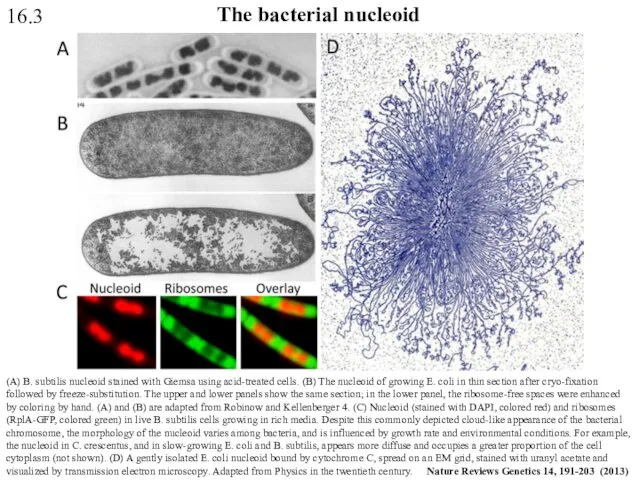
- 52. (A) B. subtilis nucleoid stained with Giemsa using acid-treated cells. (B) The nucleoid of growing E.
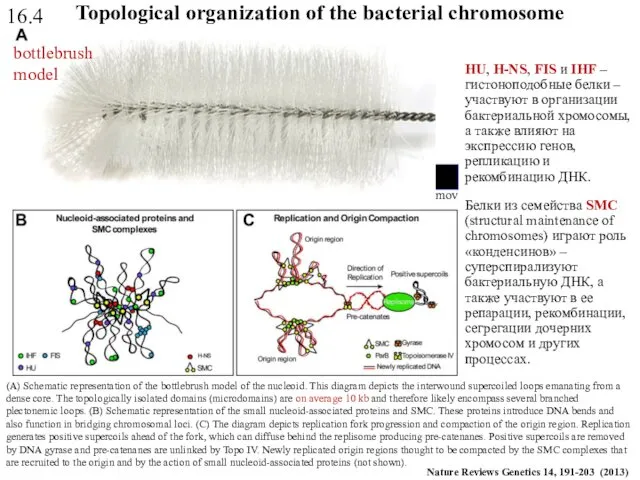
- 53. (A) Schematic representation of the bottlebrush model of the nucleoid. This diagram depicts the interwound supercoiled
- 54. 16 УПАКОВКА ДНК В ХРОМОСОМАХ Нуклеосомная фибрилла Фибрилла в форме соленоида Метафазные хромосомы
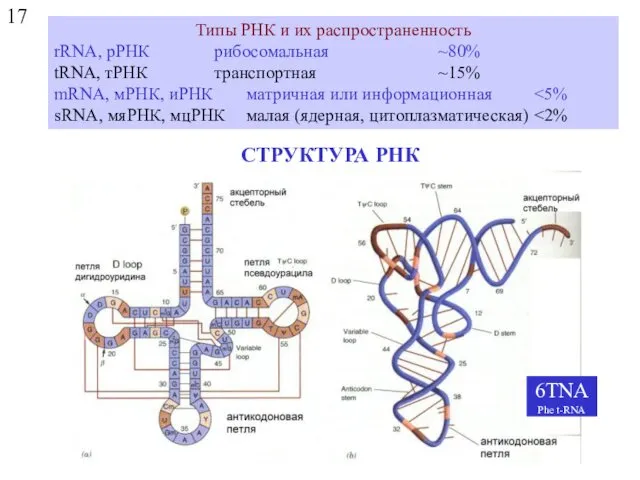
- 55. 17 СТРУКТУРА РНК Типы РНК и их распространенность rRNA, рРНК рибосомальная ~80% tRNA, тРНК транспортная ~15%
- 57. Скачать презентацию












 20231115_lyzhi_1-4_klass
20231115_lyzhi_1-4_klass Роль домашнего задания в самообразовании школьника
Роль домашнего задания в самообразовании школьника Самые необычные дома мира
Самые необычные дома мира Деструктивное поведение детей. Стратегии и тактики эффективного взаимодействия
Деструктивное поведение детей. Стратегии и тактики эффективного взаимодействия Использование датчиков в RobotC
Использование датчиков в RobotC Мировая религия пастафарианство
Мировая религия пастафарианство Состав штукатурных работ
Состав штукатурных работ Дозиметри
Дозиметри Установочная конференция (преддипломная)
Установочная конференция (преддипломная) Радиоактивность. Модели атомов
Радиоактивность. Модели атомов Open Smile Design template
Open Smile Design template Бекеттің блокты-түймелі жоспары. БМРО жүйесінің негізгі атқарушы және жинақтаушы блоктары. (Дәріс 14)
Бекеттің блокты-түймелі жоспары. БМРО жүйесінің негізгі атқарушы және жинақтаушы блоктары. (Дәріс 14) Особенности работы с детьми коррекционного класса
Особенности работы с детьми коррекционного класса Портфолио воспитателя Полеевой Веры Алексеевны
Портфолио воспитателя Полеевой Веры Алексеевны Декаплінг. Ядерний ефект оверхаузера. Динамічні ефекти в ямр
Декаплінг. Ядерний ефект оверхаузера. Динамічні ефекти в ямр Приемы работы с гофрополосками. Объемные композиции, животные. Презентация Мастер-класс Гофро-кот
Приемы работы с гофрополосками. Объемные композиции, животные. Презентация Мастер-класс Гофро-кот Оборона Воронежа в годы Великой Отечественной войны
Оборона Воронежа в годы Великой Отечественной войны С 8 марта
С 8 марта Разработка занятия по технике изонить. Первые шаги - угол.
Разработка занятия по технике изонить. Первые шаги - угол. Поворот
Поворот Qu’est-ce que c’est la Cote d’Ivoire
Qu’est-ce que c’est la Cote d’Ivoire Делать Жизнь с Кого?
Делать Жизнь с Кого? Рефінансування банків
Рефінансування банків Гетьманські столиці України
Гетьманські столиці України Аллергия. Отличие иммунитета и аллергии
Аллергия. Отличие иммунитета и аллергии Невидимі ланцюги в осінньому лісі
Невидимі ланцюги в осінньому лісі Чередующиеся гласные в корне
Чередующиеся гласные в корне Поделка оригами Зайчик
Поделка оригами Зайчик