Содержание
- 2. Подготовка к делению клетки Активация M/Cdk (MPF) Позитивная обратная связь Позитивная обратная связь Взрывообразное увеличение концентрации
- 3. Трансформация ядра в клеточном цикле Разборка ламины в профазе Филаменты ламины Тетрамер ламинов Фосфорилированные димеры ламинов
- 4. Мутантный ген ламина человека введен в клетки китайского хомячка. Замена аминокислоты в сайте фосфорилирования приводит к
- 5. Восстановление интерфазного ядра в анафазе-телофазе. Активность киназ снижается. Дефосфорилирование ламинов и их самосборка. Восстановление ядерной оболочки
- 6. Изучение стабильности микротрубочек в бесклеточной системе яиц лягушки: Центросомы Флуоресцентный тубулин Экстракт интерфаз Центросомы Флуоресцентный тубулин
- 7. Экстракт интерфазы Экстракт метафазы Экстракт метафазы, удален ХМАР215 Экстракт метафазы, удален ХМАР215, инактивирован катастрофин Влияние белков
- 8. Динамика тубулинового скелета в клеточном цикле G1 S, G2 КЦ удвоен Профаза ранняя микротрубочки астральные, полюсные
- 9. Дупликация центросомы запускается Cdk2/cycline E в переходе G1-S Далее, в S, репликация контролируется Cdk2/cycline A Polo-like-kinases
- 10. Микротрубочки, образующие веретено деления центросома Микротрубочки Астральные кинетохорные полюсные Полюс веретена кинетохоры Alberts et al., 2002
- 11. Мультимеры «минус-концевых» микротрубочковых моторов сбегаются к «-» концам, образуя «-» концевые фокусы Мультимеры «плюс-концевых» микротрубочковых моторов
- 12. Динамика присоединения хромосомы к полюсам Астральные микротрубочки. Латеральное прикрепление кинетохора к микротрубочке, скольжение Кинетохор прикрепляется к
- 13. Хромосомы позвоночных осциллируют в метафазной пластинке Движение к «─» концу вызывает кинетохор Движение к «+» концу
- 14. Механизм расхождения хромосом в анафазе Совмещение двух процессов: Анафаза А Анафаза В Укорочение кинетохорных микротрубочек Удлинение
- 15. Кинетохорные микротрубочки в метафазе -анафазе Метафаза Анафаза Разрушение «+» конца микротрубочек белками кинетохора UF меченые тубулины
- 16. Баланс активности микротрубочковых моторов «+» и «─» направлений Веретено у S.cerevisia, окраска на тубулин Оверэкспрессия Cin8p
- 17. Центромера- участок хромосомы, имеющий возможность прикрепляться к микротрубочкам. У высших организмов формируется сложная структура- кинетохор. Генетический
- 18. Наиболее простая центромера у S.serevisiae. Какая минимальная последовательность обеспечивает передачу минихромосомы? Последовательности CEN: CDE-I (cell cycle-dependent
- 20. Структура хроматина центромерного домена А - Растянутая хроматида в районе центромеры CENP-A – аналог гистона Н3:
- 21. Конститутивная центромеро-ассоциированная сеть CENP-C, -H, -I, -K, -L, -M, -N, -O, -P, -S, -T, -U, -W
- 22. Curr Opin Cell Biol. 2012 Feb;24(1):48-56. Structural organization of the kinetochore-microtubule interface KMN (комплексы Knl1, Mis12,
- 23. Dileep Varma* and E. D. Salmon Journal of Cell Science 125, 2012. KMN (комплексы Knl1, Mis12,
- 24. Cheeseman et al., 2006 Модель взаимодействия корового кинетохора с микротрубочкой (C.elegance)
- 25. SMC-белки в клеточном цикле (structural maintenance of chromosome) Конденсин впервые описали у Xenopus. Он вызывал конденсацию
- 26. SMC-белки в клеточном цикле Когезиновое кольцо Коряков, Жимулев, 2009 Когезины – семейство SMC Когезиновые кольцеобразные комплексы
- 27. Хромосомы человека, окраска антителами на конденсины (красный), ДНК окрашена DAPI (голубой) Типичная митотическая хромосома Хромосома в
- 28. Когезины и конденсины в клеточном цикле Condensins: universal organizers of chromosomes with diverse functions. T.Hirano, 2012
- 29. Когезины и конденсины в клеточном цикле. Морфология хроматина в зависимости от соотношения конденсинов 1 и 2
- 30. Активация M-Cdk: Индуцирует сборку веретена вызывает конденсацию хромосом растворение ядерной оболочки перестройку тубулинового цитоскелета реорганизацию аппарата
- 31. Роль циклина в анафазе Бесклеточный экстракт яиц лягушки. 1- Добавление Са2+ активирует деградацию циклина - нормальная
- 32. Концентрация циклина падает в конце митоза. Это вызывает разделение хроматид? Для разделения хроматид не нужно разрушение
- 33. Переход Метафаза-Анафаза Критическое возрастание MPF Polo-like киназа AuroraA,В-киназы Активация APC Инактивация MPF Активация сепаразы (разрушение циклина)
- 34. Протеолиз циклина под контролем АРС Polo-like-kinase Anaphase Promotion Complex
- 35. Переход метафаза-анафаза у дрожжей секурин неактивная сепараза Неактивный АРС Когезиновый комплекс активный АРС Cdc20 убиквитинизация и
- 36. Переход метафаза- анафаза у дрожжей Основные участники: APC - anaphase promotion complex – при добавлении субъединиц
- 37. Разделение сестринских хроматид в митозе Дрожжи: Сепараза разрезает когезины по всей длине хромосом в переходе М-А
- 38. Aurora киназа В - каталитическая субъединица СРС Survivin Borealin INCENP TD-60 CSC-1 регуляторный кор комплекса –
- 39. СРС- chromosomal passenger complex A-D- типичная локализация СРС в митозе. Культура клеток курицы . Е- распластанные
- 40. CPC, хромосомные пассажиры: белки, локализованные в специфических районах: в G2 – внутриядерно, в профазе митоза –
- 41. СРС- chromosomal passenger complex Survivin – член семейства IAP (Inhibitor of Apoptosis). RNAi в клетках HeLa
- 42. P Цитокинез Должен происходить в нужное время в нужном месте Сократительное кольцо образуется под мембраной, его
- 43. Активная форма MPF фосфорилирует легкую цепь миозина АТФ-азная активность миозина ингибируется, кольцо сокращаться не может Фосфатазы
- 44. Дробление у дрозофилы. Синхронные митозы в синцитиальной бластодерме Центросома тубулин
- 45. Митозы в имагинальном диске дрозофилы Антитела на фосфорили- рованный гистон Н3 – Маркер митоза
- 46. Ядерная оболочка Хромосомы Зона перекрывания микротрубочек Закрытый митоз у дрожжей Метафаза Анафаза Полярное тело
- 47. Митоз и мейоз
- 48. Расхождение хромосом в митозе и мейозе
- 49. Когезины Когезины – семейство SMC (structural maintenance of chromosome) белков Когезиновые кольцеобразные комплексы вводятся перед репликацией
- 50. Мейоз
- 51. Мужской и женский мейоз
- 52. Центромера и кинетохор
- 53. The Conserved KMN Network Constitutes The Core Microtubule-Binding Site of the Kinetochore I.M. Cheeseman, J.S. Chappie,
- 55. Скачать презентацию
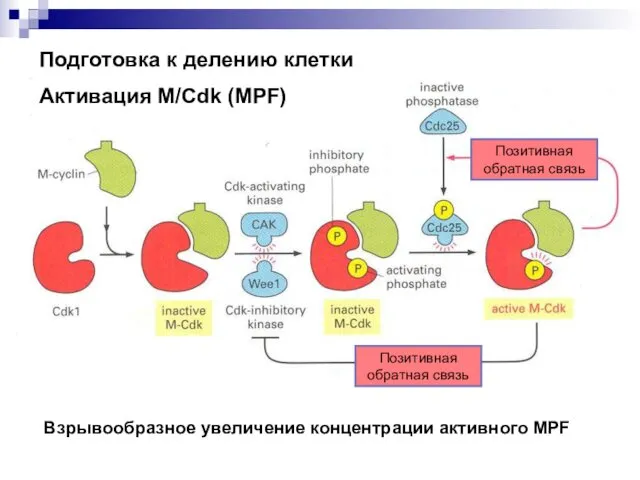
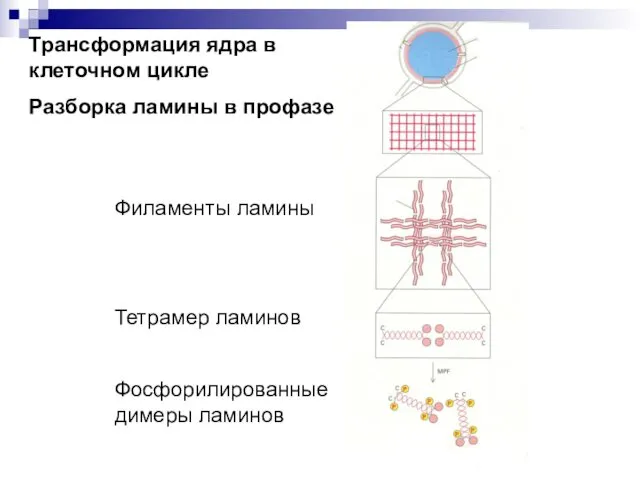
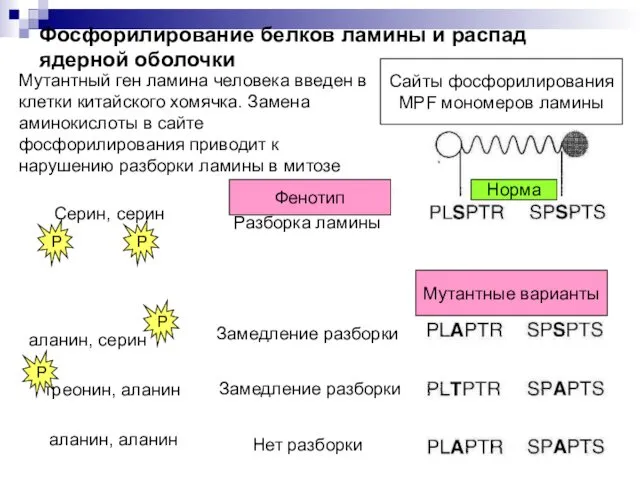
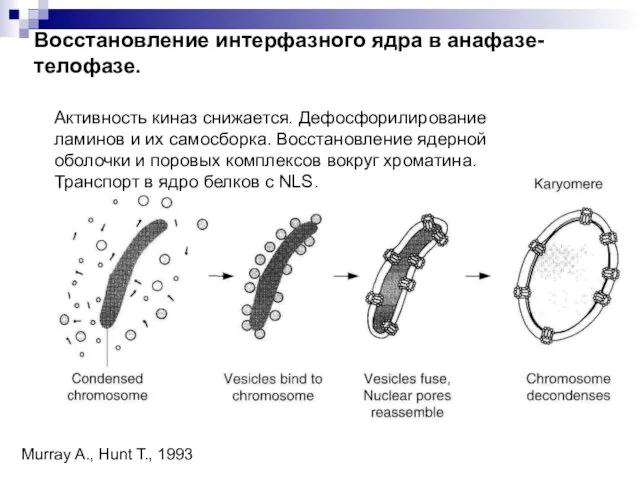
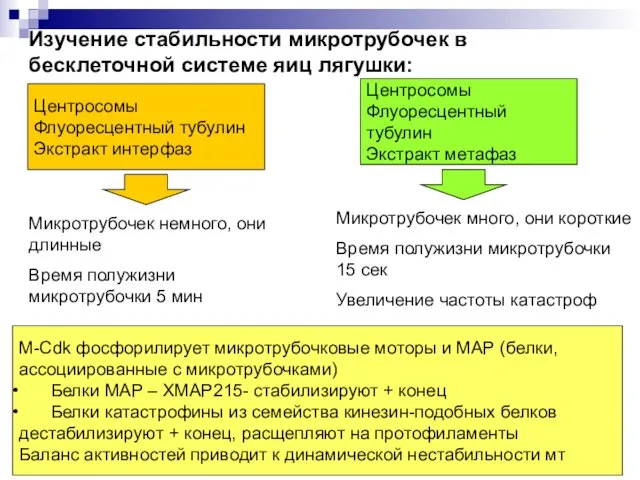
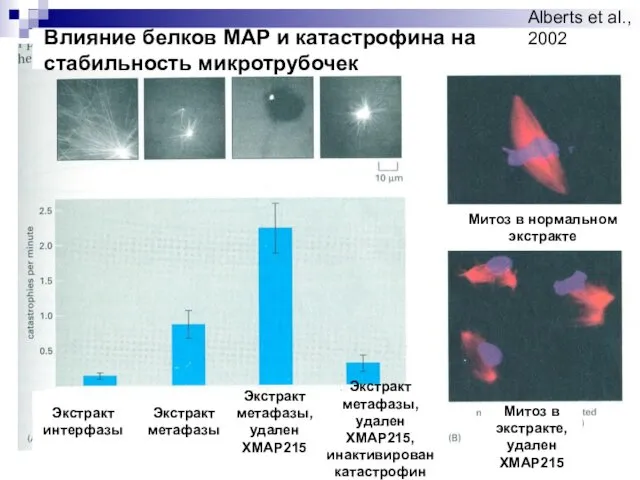
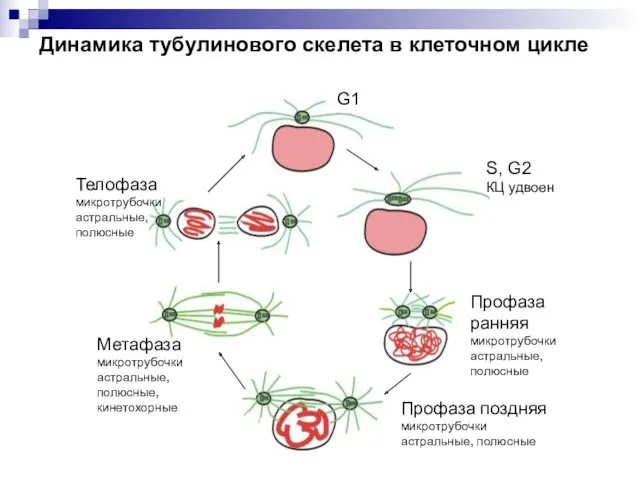
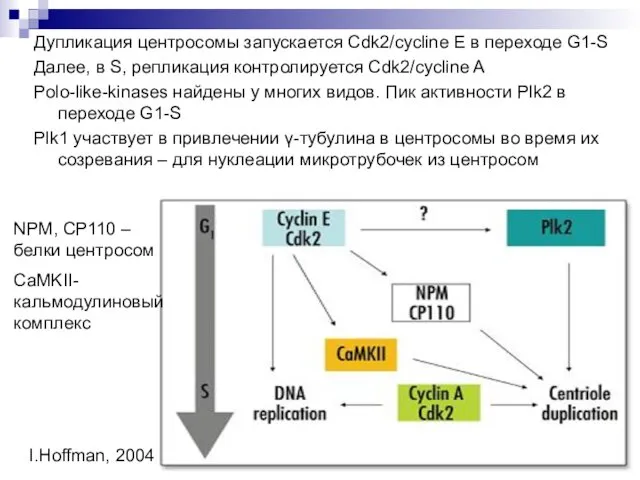
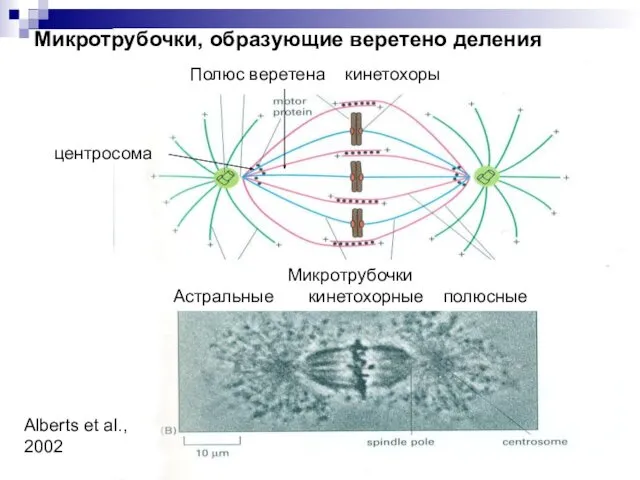
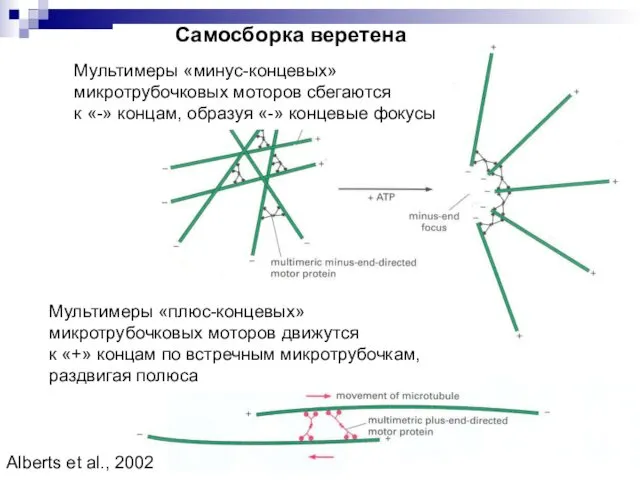
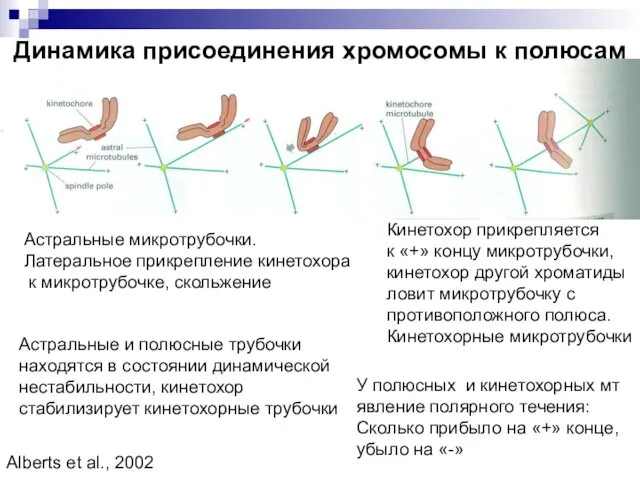
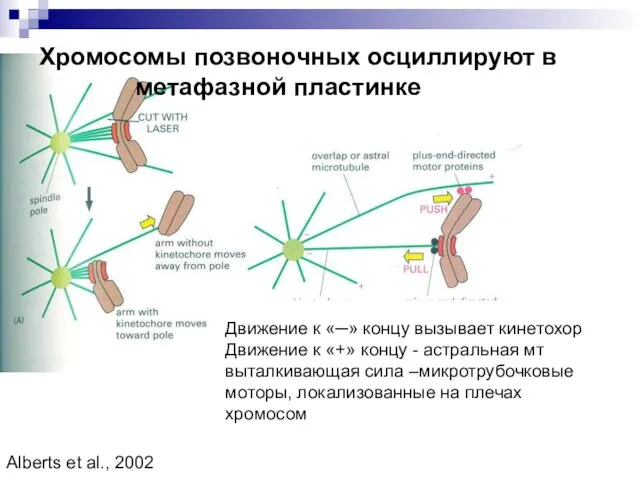
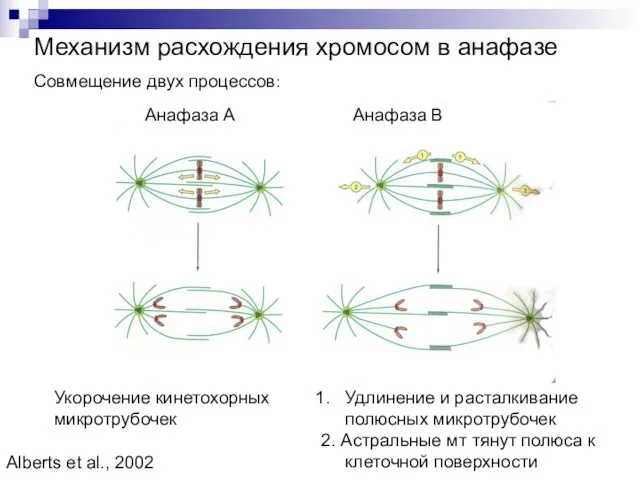
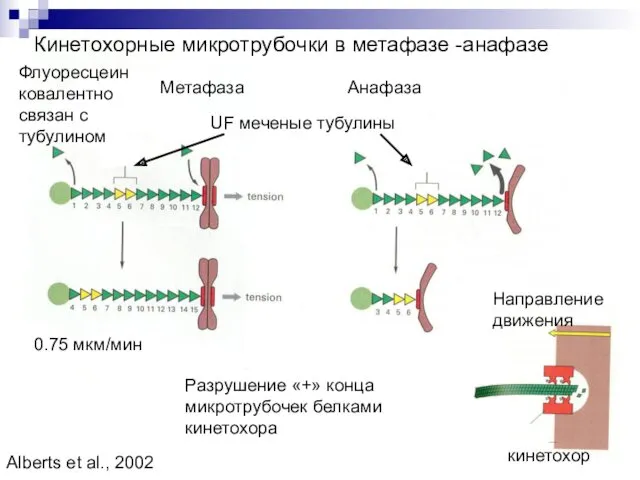
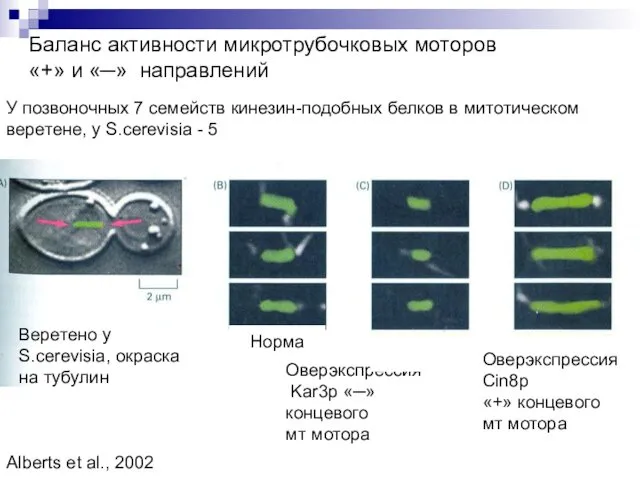

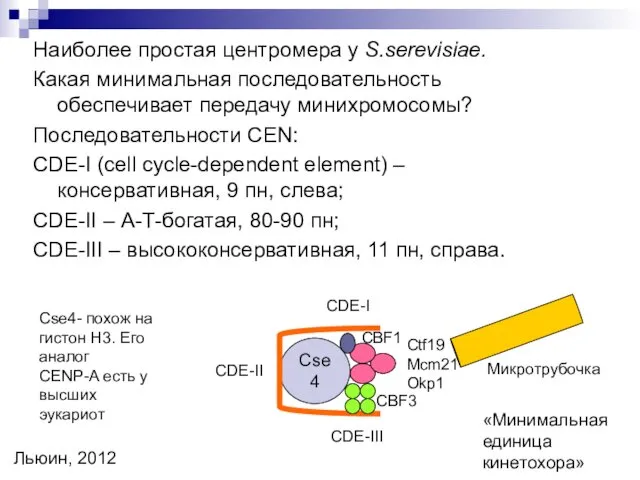
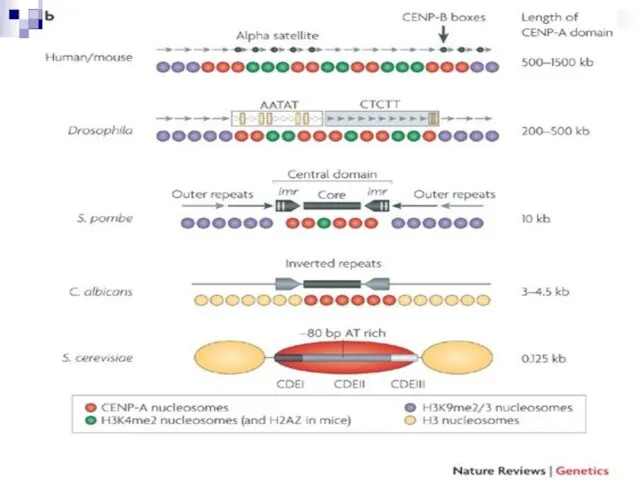
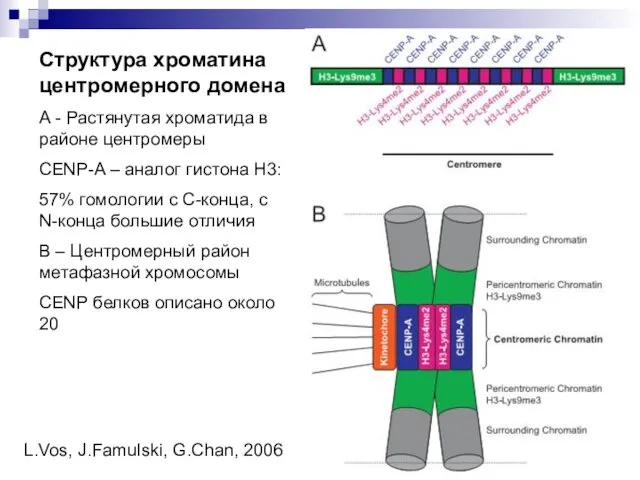
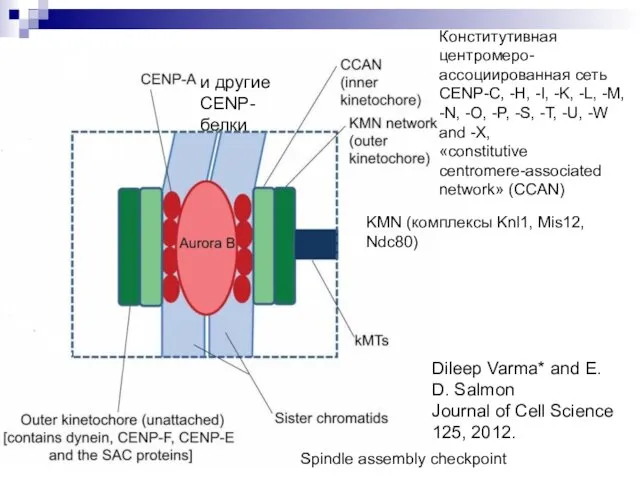
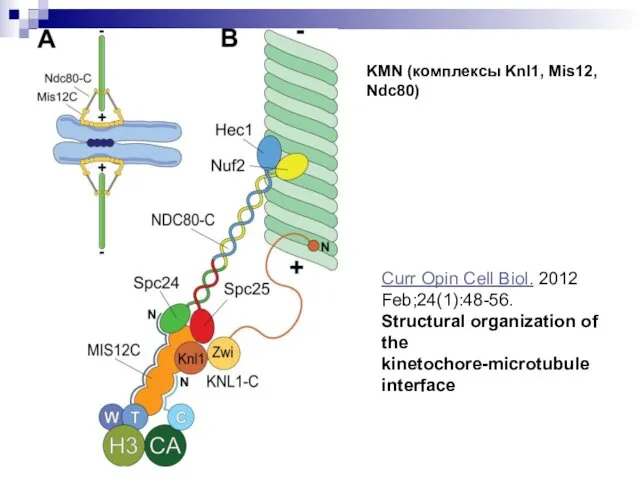
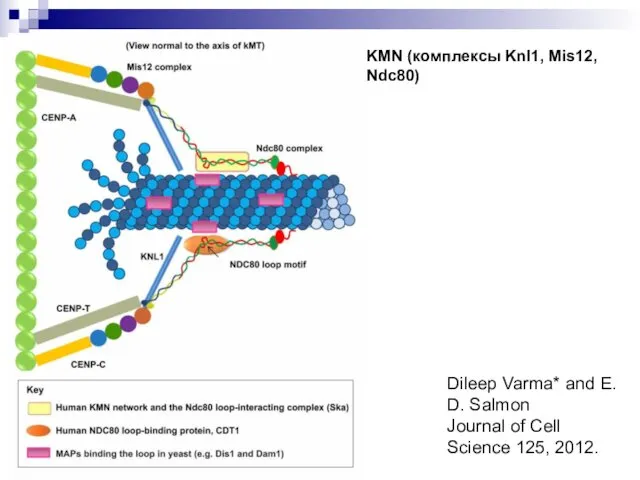
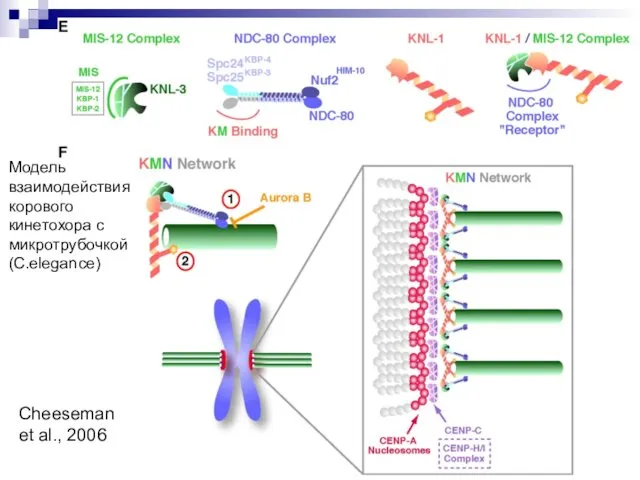
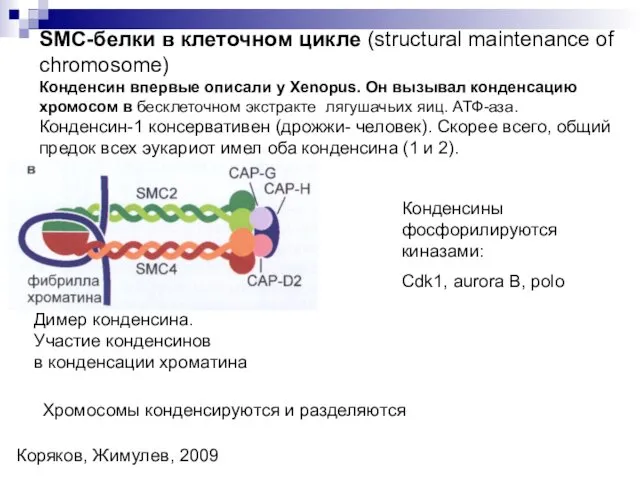
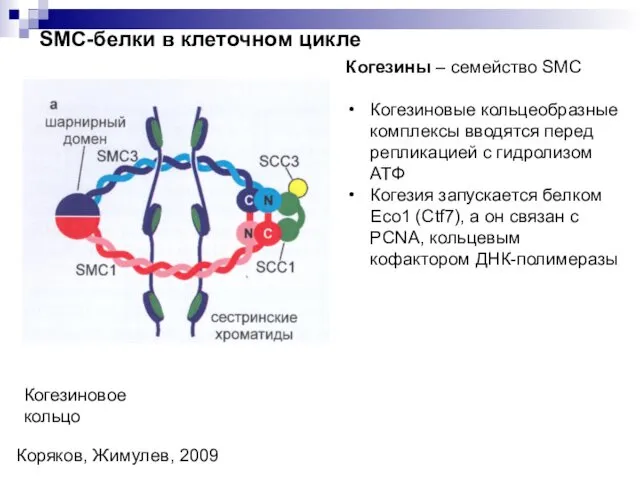
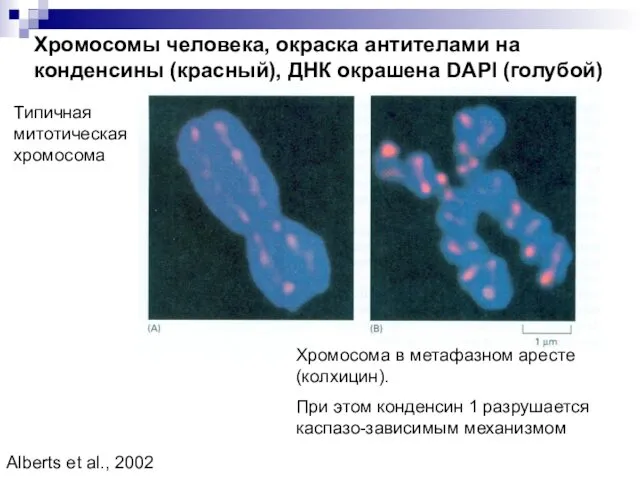
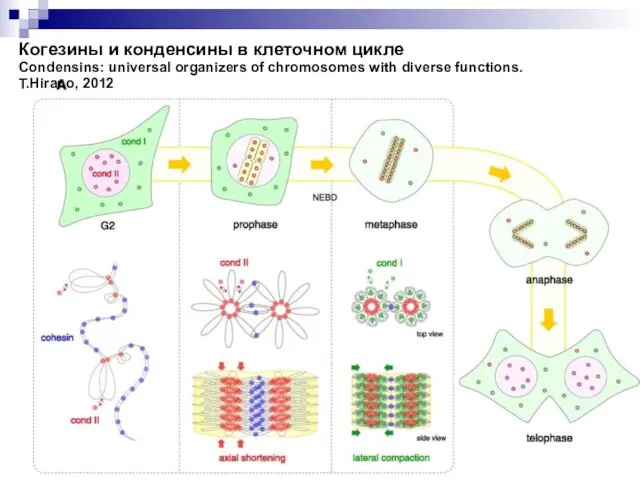
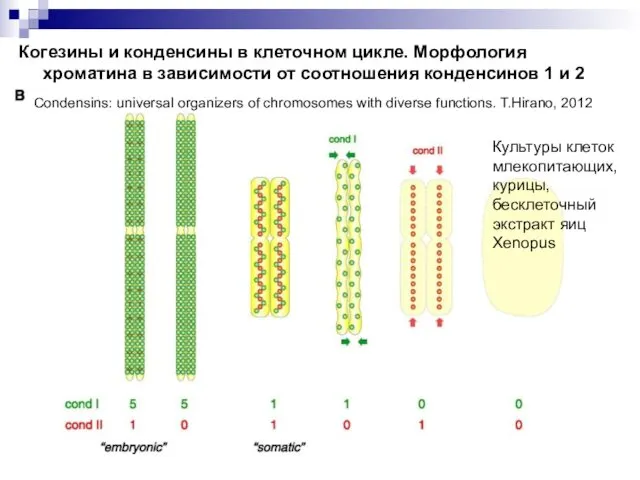
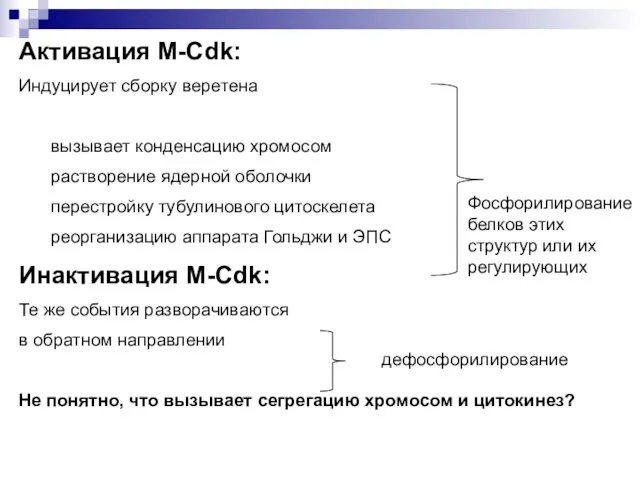
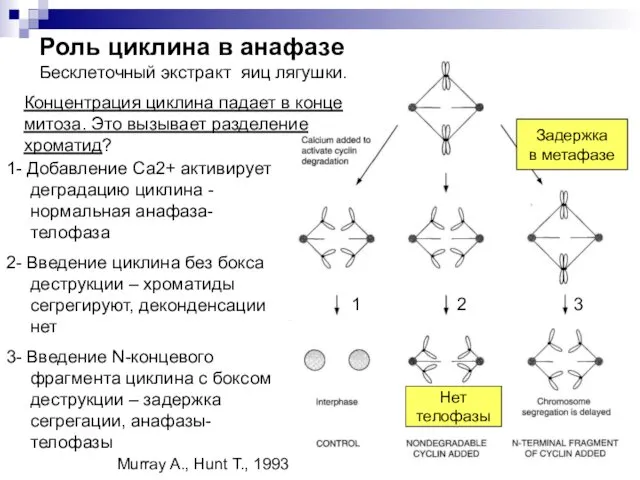
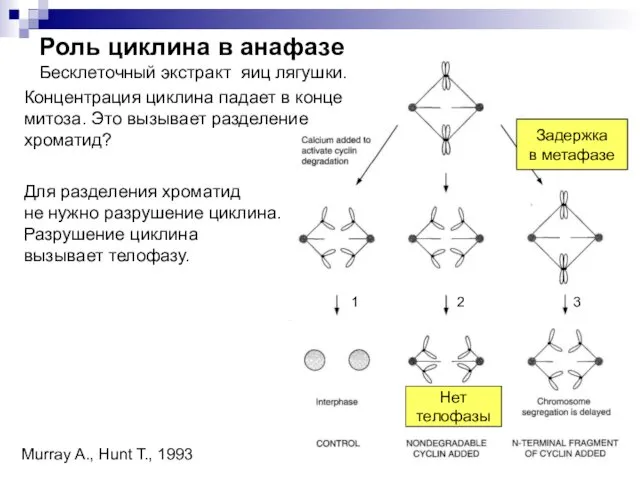
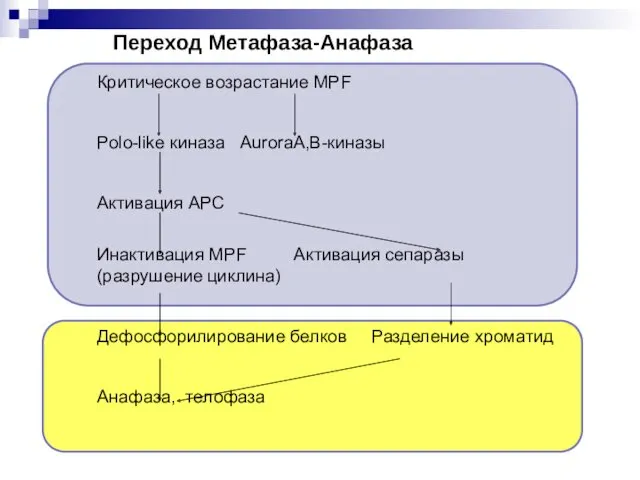
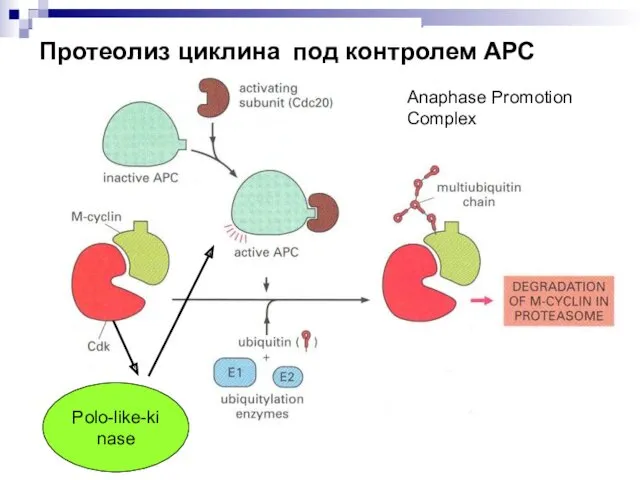
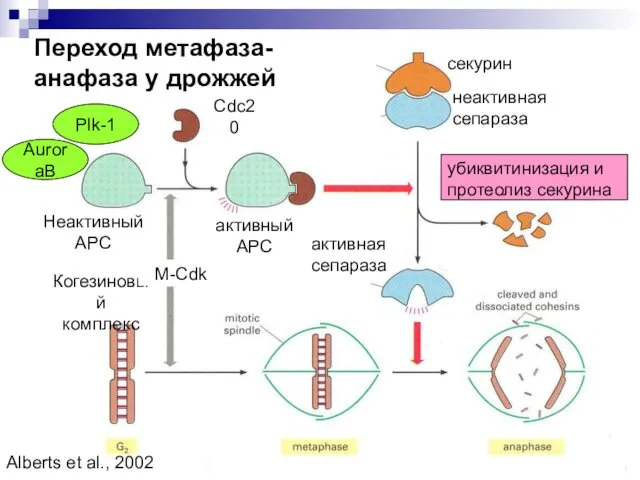



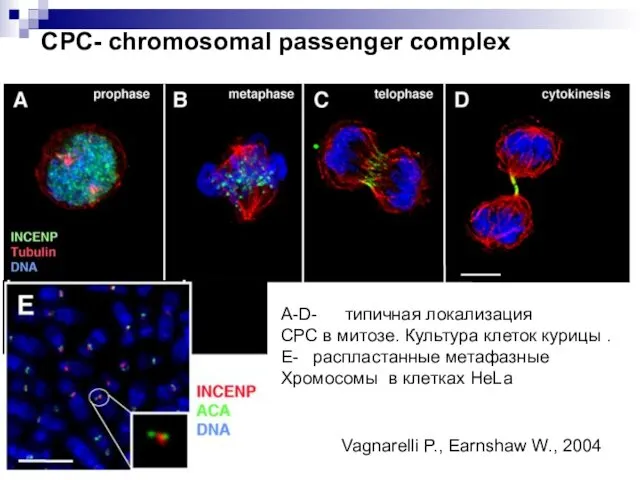


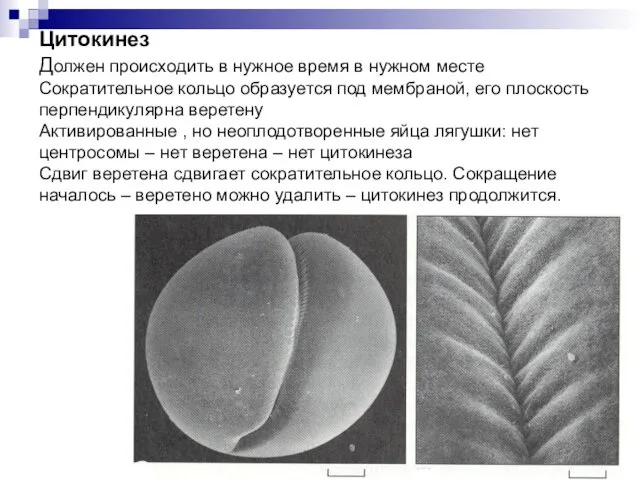
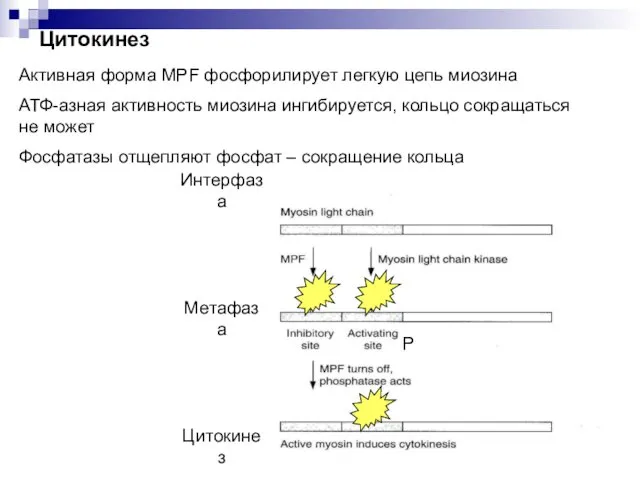
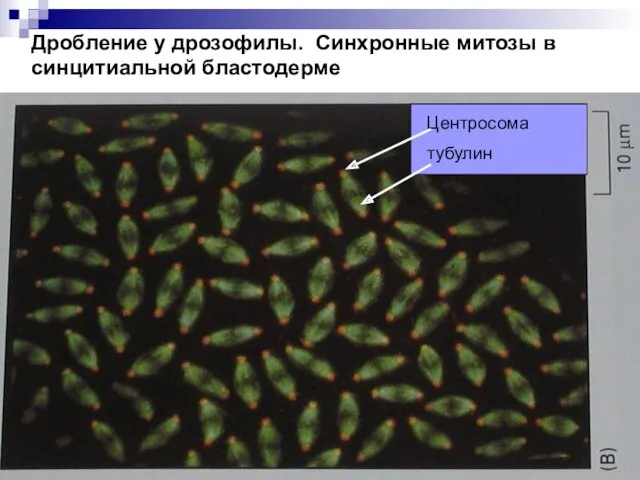
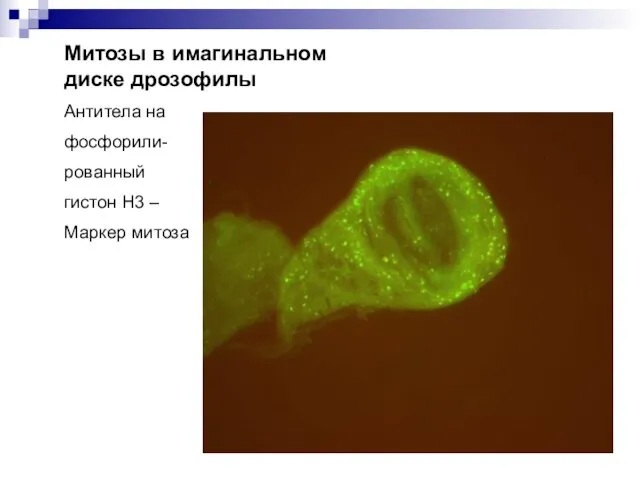

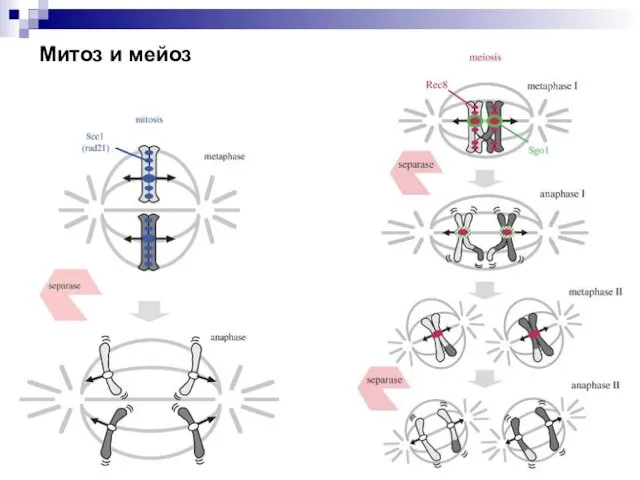
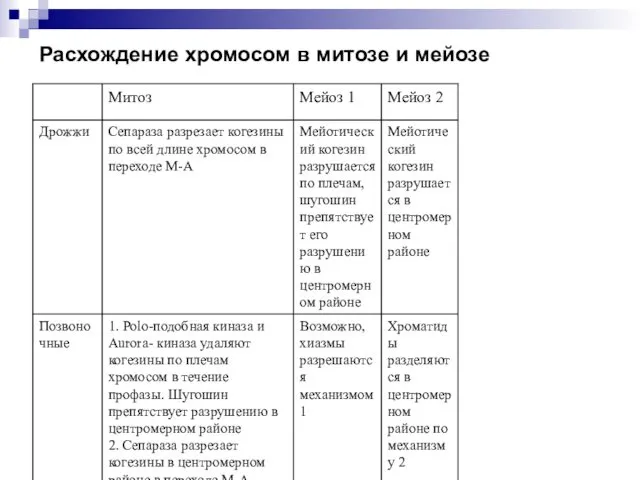

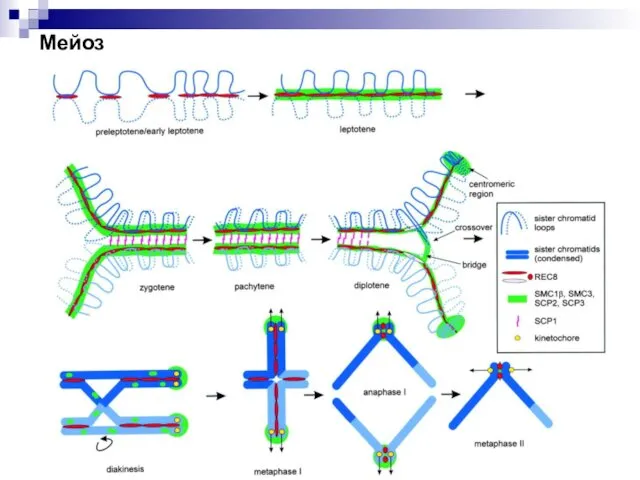
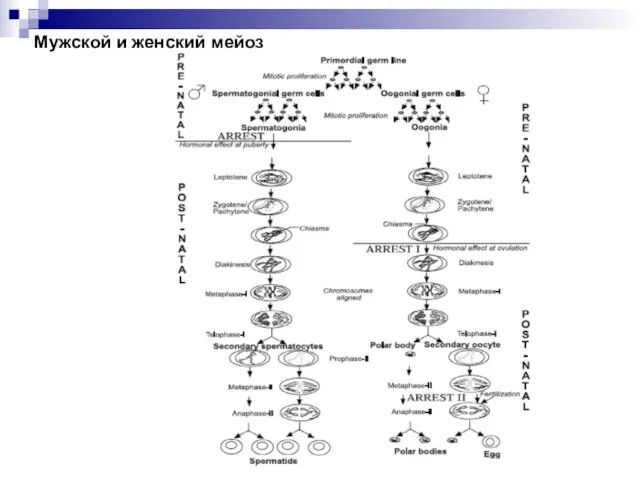
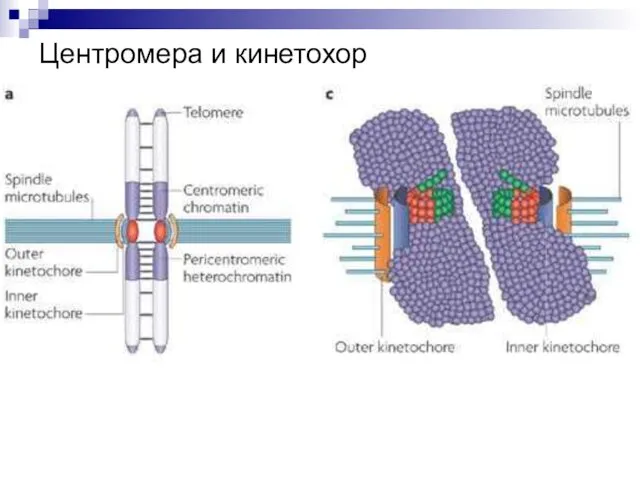

 Фото. Айсберг
Фото. Айсберг Остеоартроз (остеоартрит)
Остеоартроз (остеоартрит) Отчёт по работе Духовно-просветительского центра Глазовской епархии за 2019 год
Отчёт по работе Духовно-просветительского центра Глазовской епархии за 2019 год Storage devices
Storage devices Идеальные растворы. Законы Дальтона и Рауля
Идеальные растворы. Законы Дальтона и Рауля Исследовательский проект Красочные эксперименты.
Исследовательский проект Красочные эксперименты. Игры и задания на развитие интеллекта. 4 – 7 лет
Игры и задания на развитие интеллекта. 4 – 7 лет Трудовое право. Конвенция о правах ребенка. Конституция РФ. Трудовой кодекс РФ. Отдельные законы о труде
Трудовое право. Конвенция о правах ребенка. Конституция РФ. Трудовой кодекс РФ. Отдельные законы о труде Понятие об инфекционном процессе и инфекционных болезнях
Понятие об инфекционном процессе и инфекционных болезнях Датчики для метеостанции. Структурная и принципиальная схема разрабатываемой метеостанции. Конструкторские расчеты
Датчики для метеостанции. Структурная и принципиальная схема разрабатываемой метеостанции. Конструкторские расчеты Полеты в космос
Полеты в космос Простое оштукатуривание стен строительного склада цементным раствором и ремонт облицовки пола керамической метлахской плиткой
Простое оштукатуривание стен строительного склада цементным раствором и ремонт облицовки пола керамической метлахской плиткой Машинобудування та металообробка Харківської області
Машинобудування та металообробка Харківської області История России в первой половине ХХ века
История России в первой половине ХХ века Народная игрушка
Народная игрушка Сочинение на тему Чем мне запомнилась картина Валентина Александровича Серова Мика Морозов
Сочинение на тему Чем мне запомнилась картина Валентина Александровича Серова Мика Морозов Презентация Я-лидер.
Презентация Я-лидер. Профессия воспитатель
Профессия воспитатель Безработица в России: типы, социальна структура, особенности динамики в условиях формирования цифровой экономики
Безработица в России: типы, социальна структура, особенности динамики в условиях формирования цифровой экономики Death by PowerPoint (and how to fight it)
Death by PowerPoint (and how to fight it) Природные ресурсы земной коры
Природные ресурсы земной коры Свойства числовых неравенств
Свойства числовых неравенств Презентация русско-французского образовательного проекта Защитим окружающий мир вместе
Презентация русско-французского образовательного проекта Защитим окружающий мир вместе Удивительные доисторические животные Южной Америки
Удивительные доисторические животные Южной Америки Слоговая структура слова 4-го типа в предложениях
Слоговая структура слова 4-го типа в предложениях Характеристика, типы и виды волос и ногтей. Основы строения и физиологии кожи, волос и ногтей
Характеристика, типы и виды волос и ногтей. Основы строения и физиологии кожи, волос и ногтей Методический семинар Создание персонального сайта учителя
Методический семинар Создание персонального сайта учителя Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)