Содержание
- 2. 1. Основные понятия и определения молекулярной физики и термодинамики Совокупность тел, составляющих макроскопическую систему, называется термодинамической
- 4. Любой параметр, имеющий определённое значение для каждого равновесного состояния, является функцией состояния системы. Равновесной, называется такая
- 5. Процесс – переход из одного равновесного состояния в другое. Релаксация – возвращение системы в равновесное состояние.
- 6. Атомная единица массы (а.е.м.) – (mед) – единица массы, равная 1/12 массы изотопа углерода 12С –
- 7. Молекулярная масса (молекулярный вес): Отсюда можно найти массу атома и молекулы в килограммах:
- 8. В термодинамике широко используют понятия киломоль, моль, число Авогадро и число Лошмидта. Моль – это стандартизированное
- 9. В 1811 г. Авогадро высказал предположение, что число частиц в киломоле любого вещества постоянно и равно
- 10. При одинаковых температурах и давлениях все газы содержат в единице объёма одинаковое число молекул. Число молекул
- 11. Идеальный газ – это газ для которого: - радиус взаимодействия двух молекул много меньше среднего расстояния
- 12. Следует помнить, что классические представления в молекулярно-кинетической теории и термодинамике, как и вообще в микромире, не
- 13. 2. Давление. Основное уравнение молекулярно-кинетической теории Рассмотрим подробнее, что представляет собой один из основных параметров состояния
- 14. Итак, находящиеся под давлением газ или жидкость действуют с некоторой силой на любую поверхность, ограничивающую их
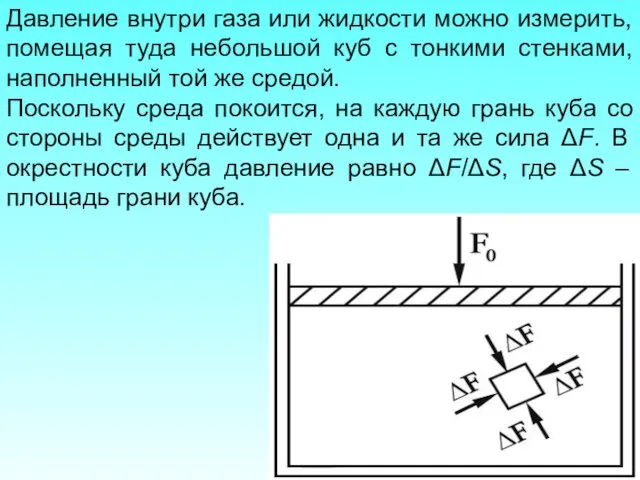
- 15. Давление внутри газа или жидкости можно измерить, помещая туда небольшой куб с тонкими стенками, наполненный той
- 16. Внутреннее давление является одним и тем же во всех направлениях, и, во всем объеме независимо от
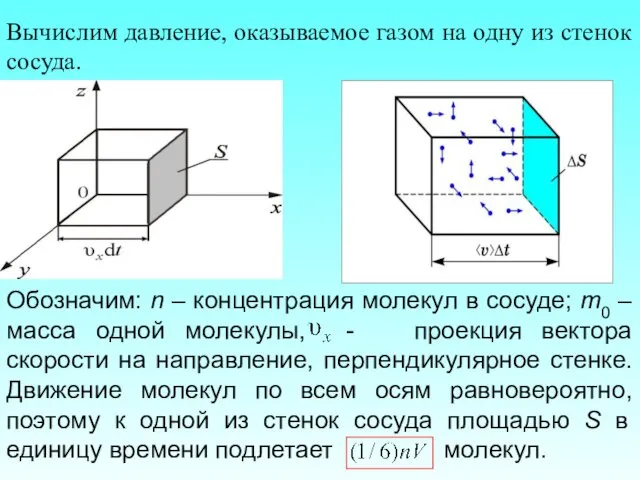
- 17. Вычислим давление, оказываемое газом на одну из стенок сосуда. Обозначим: n – концентрация молекул в сосуде;
- 18. Каждая молекула обладает импульсом m0υx, но стенка получает импульс (при абсолютно-упругом ударе ). За время dt
- 19. Таким образом, мы определили давление, как силу, действующую в единицу времени на единицу площади: Молекулы имеют
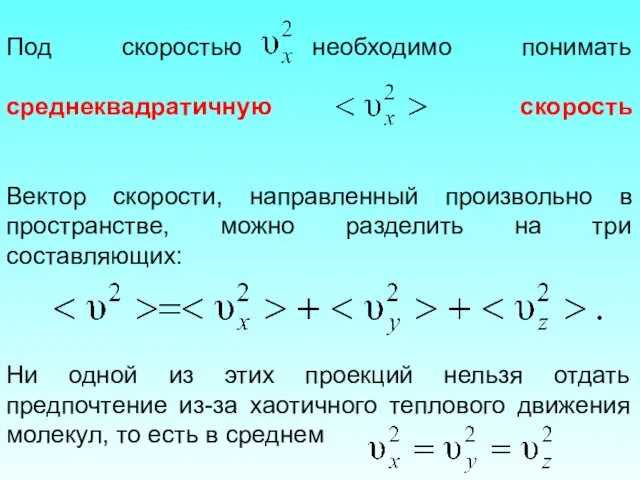
- 20. Под скоростью необходимо понимать среднеквадратичную скорость Вектор скорости, направленный произвольно в пространстве, можно разделить на три
- 21. Следовательно, на другие стенки будет точно такое же давление. Тогда можно записать в общем случае: где
- 22. Единицы измерения давления. По определению, поэтому размерность давления 1 Н/м2 = 1Па; 1 атм.= 9,8 Н/см2
- 23. 3. Температура и средняя кинетическая энергия теплового движения молекул Если привести в соприкосновение два тела: горячее
- 24. Чтобы связать энергию с температурой, Больцман ввел коэффициент пропорциональности k, который впоследствии был назван его именем:
- 25. Величину T называют абсолютной температурой и измеряют в градусах Кельвина (К). Она служит мерой кинетической энергии
- 26. Так как температура определяется средней энергией движения молекул, то она, как и давление, является статистической величиной,
- 27. Основное уравнение молекулярно-кинетической теории можно записать по другому. Так как Отсюда В таком виде основное уравнение
- 28. Термометры. Единицы измерения температуры Наиболее естественно было бы использовать для измерения температуры определение т.е. измерять кинетическую
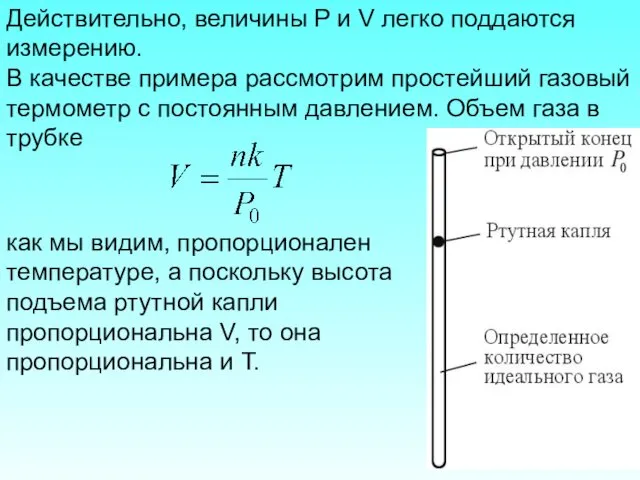
- 29. Действительно, величины P и V легко поддаются измерению. В качестве примера рассмотрим простейший газовый термометр с
- 30. Существенно то, что в газовом термометре необходимо использовать идеальный газ. Если же в трубку вместо идеального
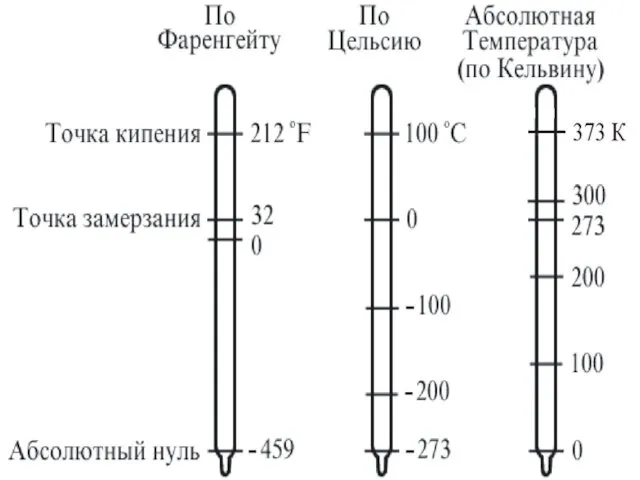
- 31. В физике и технике за абсолютную шкалу температур принята шкала Кельвина, названная в честь знаменитого английского
- 33. Свойства температуры: абсолютная температура всегда положительна не обладает свойством аддитивности невозможно достичь абсолютного нуля Современная термометрия
- 34. 4. Законы идеальных газов В XVII – XIX веках были сформулированы опытные законы идеальных газов Изопроцессы
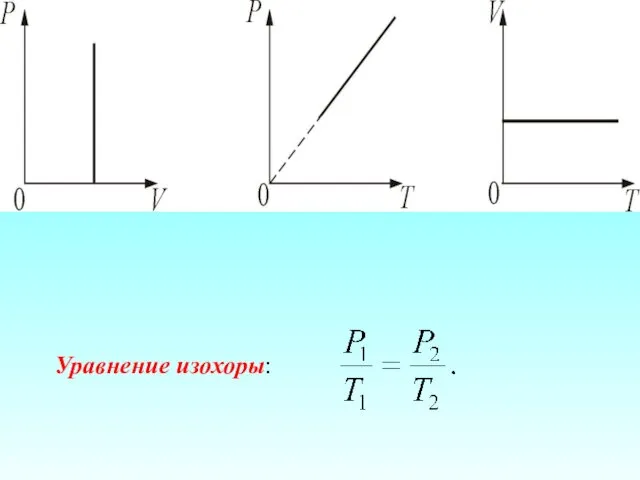
- 35. 1.Изохорический процесс. V = const. Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа
- 36. Уравнение изохоры:
- 37. Если температура газа выражена в градусах Цельсия, то уравнение изохорического процесса записывается в виде где Р0
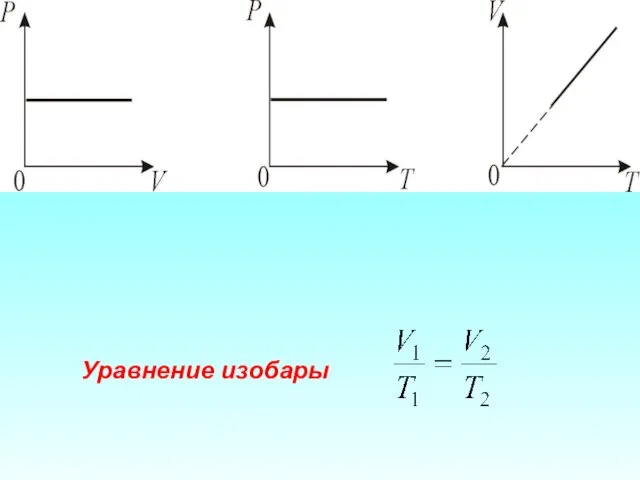
- 38. 2. Изобарический процесс. Р = const. Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение
- 39. Уравнение изобары
- 40. Если температура газа выражена в градусах Цельсия, то уравнение изобарического процесса записывается в виде где −
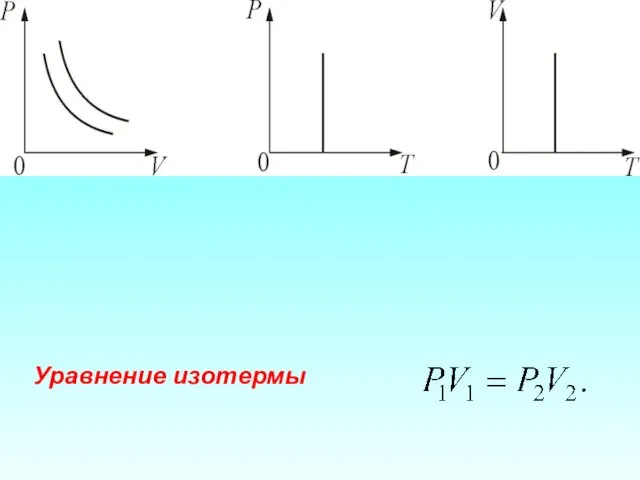
- 41. 3. Изотермический процесс. T = const. Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение
- 42. Уравнение изотермы
- 43. 4. Адиабатический процесс (изоэнтропийный). Процесс, происходящий без теплообмена с окружающей средой. 5. Политропический процесс. Процесс, при
- 44. 6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится
- 45. 7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов
- 46. 8. Объединённый газовый закон (Закон Клапейрона). В соответствии с законами Бойля - Мариотта (1.4.5) и Гей-Люссака
- 47. 5. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) Идеальным газом называют газ, молекулы которого пренебрежимо малы, по
- 48. Менделеев объединил известные нам законы Бойля-Мариотта, Гей-Люссака и Шарля с законом Авогадро. Уравнение, связывающее все эти
- 49. Если обозначим – плотность газа, то Если рассматривать смесь газов, заполняющих объём V при температуре Т,
- 51. Скачать презентацию







































 Мнемотехника
Мнемотехника Фотоальбом. В память о любимой мамочке
Фотоальбом. В память о любимой мамочке Приобретенные пороки сердца
Приобретенные пороки сердца Конфликтные картинки
Конфликтные картинки Альтернативные источники энергии
Альтернативные источники энергии Биологическая очистка сточных вод
Биологическая очистка сточных вод Скважина, ее элементы и конструкции. Классификация скважин
Скважина, ее элементы и конструкции. Классификация скважин Семья. Традиции. Обычаи. Семейные ценности
Семья. Традиции. Обычаи. Семейные ценности : Лекарственные растения.
: Лекарственные растения. Анализ ситуации на рынке энергоресурсов
Анализ ситуации на рынке энергоресурсов Презентация ко дню матери Милая мама
Презентация ко дню матери Милая мама формирование вокально-хоровых навыков у дошкольников
формирование вокально-хоровых навыков у дошкольников Контроль технического состояния скважин. Лекция № 6
Контроль технического состояния скважин. Лекция № 6 Сенсорное развитие детей раннего возраста
Сенсорное развитие детей раннего возраста Карбонильные соединения - альдегиды
Карбонильные соединения - альдегиды Основы организации строительства и реконструкции железных дорог
Основы организации строительства и реконструкции железных дорог Картофель. Продукты из картофеля
Картофель. Продукты из картофеля Применение смазочно-охлаждающих жидкостей (СОЖ)
Применение смазочно-охлаждающих жидкостей (СОЖ) Технология формирования иноязычных грамматических навыков
Технология формирования иноязычных грамматических навыков Суицидальное поведение детей и подростков: определение, виды, причины, выявление
Суицидальное поведение детей и подростков: определение, виды, причины, выявление Современные методы инженерной защиты от оползней
Современные методы инженерной защиты от оползней Презентация Правила пожарной безопасности в лесу
Презентация Правила пожарной безопасности в лесу Предвыборная программа Шаровой Полины
Предвыборная программа Шаровой Полины Узор в полосе для косынки треугольной формы. 2 класс специальной коррекционной школы
Узор в полосе для косынки треугольной формы. 2 класс специальной коррекционной школы План -конспект урока по химии в 9 классе Ионные уравнения с презентацией
План -конспект урока по химии в 9 классе Ионные уравнения с презентацией Как вывести предприятие из финансового кризиса
Как вывести предприятие из финансового кризиса МЕТОДИЧЕСКИЙ ДОКЛАД и презентация на тему: Нетрадиционные методы обучения или о таинстве простых
МЕТОДИЧЕСКИЙ ДОКЛАД и презентация на тему: Нетрадиционные методы обучения или о таинстве простых Let’s make some pancakes
Let’s make some pancakes