*
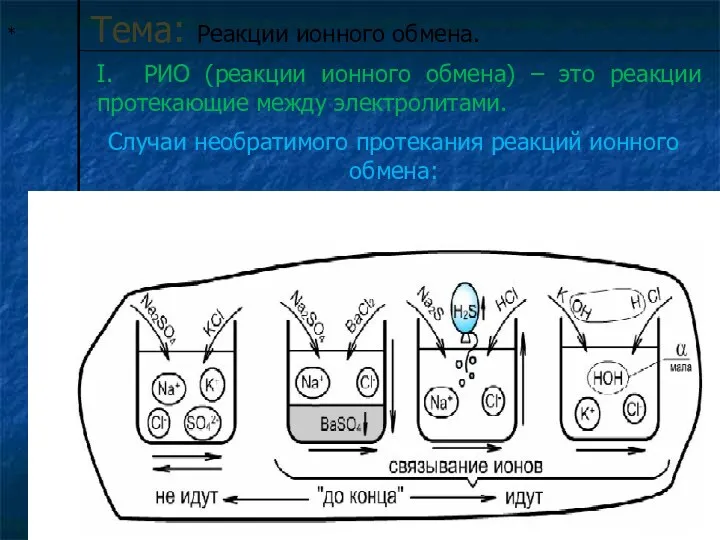
Тема: Реакции ионного обмена.
I. РИО (реакции ионного обмена) – это реакции
протекающие между электролитами.
Пример: Взаимодействие хлорида бария с сульфатом натрия.
BaCl2 + Na2SO4 ? BaSO4 + NaCl
Ba2+
2Cl-
+
+
2Na+
SO42-
+
1. Записать уравнение реакции в молекулярном виде.
Порядок действий:
2. Расставить коэффициенты.
2
3. По таблице растворимости, определить нерастворимые вещества. Обозначить их стрелкой вниз.
4. Составить полное ионное уравнение (растворимые вещества расписать на ионы.
?
BaSO4
+
2Na+
+
2Cl-
5. Сократить одинаковые ионы в левой и правой части полного ионного уравнения.
6. Составить сокращенное ионное уравнение.
Ba2+
+
SO42-
?
BaSO4









 Презентация проекта Игры и упражнения по формированию звукопроизношения у детей старшего дошкольного возраста
Презентация проекта Игры и упражнения по формированию звукопроизношения у детей старшего дошкольного возраста Использование информационных технологий на уроках в начальной школе
Использование информационных технологий на уроках в начальной школе Картины Леонардо да Винчи
Картины Леонардо да Винчи Индустриализация в СССР
Индустриализация в СССР Огтогенез
Огтогенез Машины и механизмы, применяемые при монтаже и эксплуатации контактной сети и воздушных линий
Машины и механизмы, применяемые при монтаже и эксплуатации контактной сети и воздушных линий Новое в стипендиальном обеспечении обучающихся
Новое в стипендиальном обеспечении обучающихся День отца. Традиции
День отца. Традиции ПРЕЗЕНТАЦИЯ К ОПЫТУ РАБОТЫ
ПРЕЗЕНТАЦИЯ К ОПЫТУ РАБОТЫ 10 Things You May Not Know About “Typhoid Mary”
10 Things You May Not Know About “Typhoid Mary” Классификация операционных систем
Классификация операционных систем Основные принципы и нормативно-правовая база защиты населения от ЧС
Основные принципы и нормативно-правовая база защиты населения от ЧС Презентация к классному часу
Презентация к классному часу Презентация к уроку крымскотатарского языка.
Презентация к уроку крымскотатарского языка. Химические свойства щелочных металлов
Химические свойства щелочных металлов Подольские курсанты
Подольские курсанты Презентация ФГОС Основное общее образование
Презентация ФГОС Основное общее образование математический язык
математический язык Компрессоры ГТД
Компрессоры ГТД Презентация Зимующие птицы
Презентация Зимующие птицы презентация Канада
презентация Канада Методика формирования основных компонентов содержания географического образования
Методика формирования основных компонентов содержания географического образования Коррозия
Коррозия Су-Джок терапия
Су-Джок терапия ҚазМұнайГаз компаниясына SWOT-талдау
ҚазМұнайГаз компаниясына SWOT-талдау Феникс: спортивный клуб. Пермь
Феникс: спортивный клуб. Пермь Задержка мочеиспускания
Задержка мочеиспускания Праздник-соревнование Папа, мама, я - весёлая семья
Праздник-соревнование Папа, мама, я - весёлая семья