Молекулярно-кинетическая теория. Идеальный газ. Уравнение молекулярно-кинетической теории идеального газа. Закон Дальтона презентация
Содержание
- 2. 1. Основные положения молекулярно-кинетической теории и их опытное обоснование. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального
- 3. Молекулярно-кинетической теорией называется учение о строении и свойствах вещества, использующее представления о существовании атомов и молекул
- 4. Фактом, подтверждающим существование молекул, является возможность определить их массу и размеры (ионный микроскоп, рентгеноструктурный анализ, масс-спектроскопия,
- 5. Единица количества вещества называется молем. Моль равен количеству вещества, содержащего столько же частиц, сколько атомов содержится
- 6. Она показывает, сколько атомов или молекул содержится в одном моле вещества. Молярная масса - это масса
- 7. Молярная масса может быть вычислена через массу молекулы Mr, измеренную в атомных единицах массы.
- 8. Модель идеального газа предполагает следующее: молекулы обладают пренебрежимо малым объемом, между молекулами не действуют силы притяжения,
- 9. На основе использования законов динамики и положений молекулярно-кинетической теории было получено основное уравнение МКТ. где m0
- 10. Обозначив среднее значение кинетической энергии поступательного движения Е: получим
- 11. Если сосуд заполнили смесью газов, то давление смеси равно сумме парциальных давлений газов (закон Дальтона): .
- 12. 2. Температура. Связь температуры со скоростью движения молекул. Температурные шкалы
- 13. Состояние системы, при котором макроскопические параметры, характеризующие ее, остаются длительное время неизменными, называется тепловым равновесием.
- 14. Экспериментальные исследования показали, что для любых газов, находящихся в тепловом равновесии, отношение произведения давления газа на
- 15. Так как
- 16. Следовательно, средняя кинетическая энергия молекул любых газов, находящихся в тепловом равновесии одинакова. Величина Θ измеряется в
- 17. В физике обычно температуру измеряют в градусах, принимая, что температура Т и величина Θ связаны уравнением
- 18. Шкала измерения температуры в соответствии с этим уравнением называется абсолютной шкалой. Ее предложил английский физик У.Кельвин.
- 19. С введением постоянной Больцмана следует еще одно из уравнений молекулярно-кинетической теории
- 20. Сравнив последнее уравнение с уравнением Получим
- 21. Итак, температура – есть мера средней кинетическая энергия хаотического движения молекул газа.
- 22. Исходя из этого, легко рассчитать среднюю квадратичную скорость движения молекул Соотношение подтверждено экспериментально (опыт Штерна).
- 23. 3. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). Изотермический, изохорный и изобарный процессы
- 24. Используя зависимость давления газа от его температуры и концентрации молекул можно найти связь между основными макроскопическими
- 25. Число молекул газа где R=NAk называется универсальной газовой постоянной R=8,31 Дж/(моль К). Соотношение называют уравнением состояния
- 26. При неизменной массе газа величина Поэтому
- 27. Процессы, происходящие при неизменном значении одного из параметров состояния называются изопроцессами.
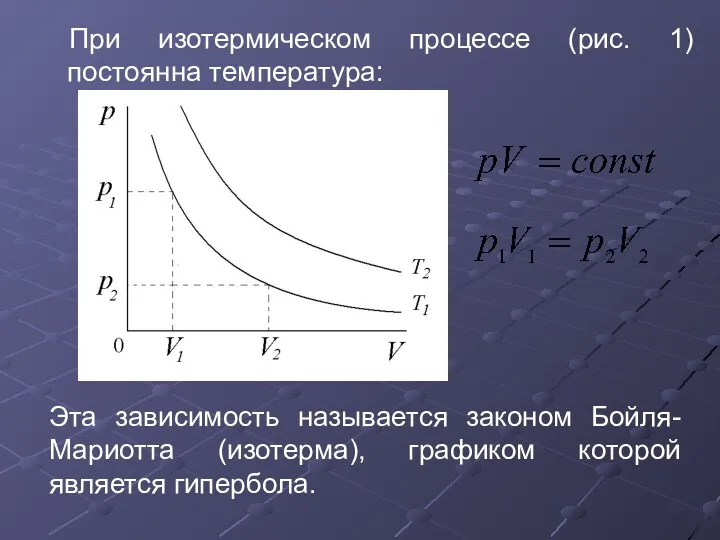
- 28. При изотермическом процессе (рис. 1) постоянна температура: Эта зависимость называется законом Бойля-Мариотта (изотерма), графиком которой является
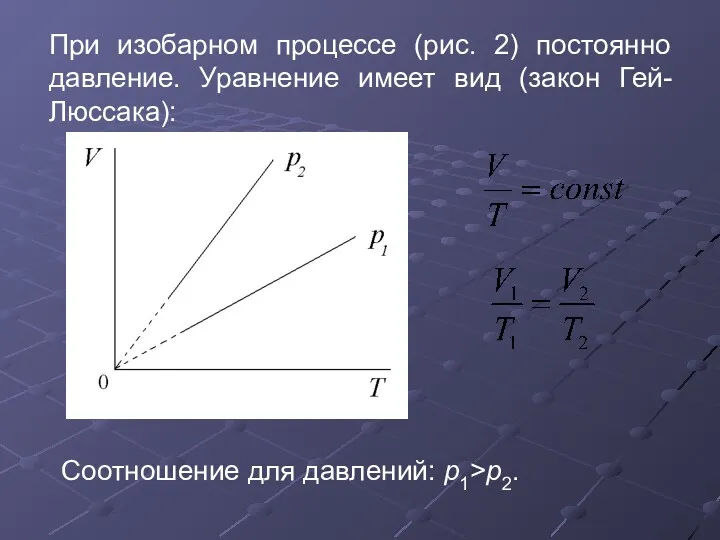
- 29. При изобарном процессе (рис. 2) постоянно давление. Уравнение имеет вид (закон Гей-Люссака): Соотношение для давлений: p1>p2.
- 30. Выбирая начальное состояние, соответствующее Т0=273К, запишем Соотношение связывает объем газа и его температуру (0С) при изобарном
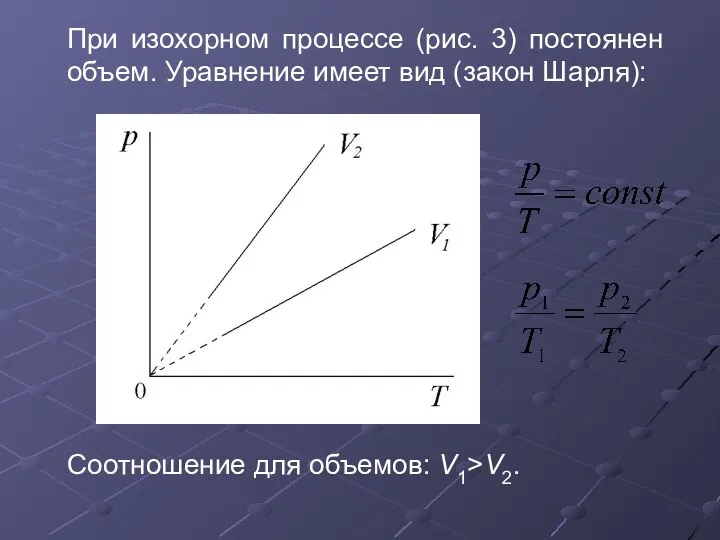
- 31. При изохорном процессе (рис. 3) постоянен объем. Уравнение имеет вид (закон Шарля): Соотношение для объемов: V1>V2.
- 33. Скачать презентацию



























 С праздником весны!
С праздником весны! Мультимедийная презентация на тему Насколько велик моль?
Мультимедийная презентация на тему Насколько велик моль? презентация по ОРКСЭ 4 класс
презентация по ОРКСЭ 4 класс Презентация проекта Весёлые ручки
Презентация проекта Весёлые ручки Химическая организация клетки. Неорганические вещества
Химическая организация клетки. Неорганические вещества Взаимное расположение графиков линейной функции
Взаимное расположение графиков линейной функции 1959 оной гахай жэлээхид та бугэдэниие Сагаан hараар, сагаалганаар амаршална
1959 оной гахай жэлээхид та бугэдэниие Сагаан hараар, сагаалганаар амаршална О родных и близких людях с любовью
О родных и близких людях с любовью Презентация к празднику Свет родных берёз
Презентация к празднику Свет родных берёз Фасовочно-упаковочное оборудование
Фасовочно-упаковочное оборудование Справочно-правовая система (СПС) Консультант плюс
Справочно-правовая система (СПС) Консультант плюс Вышивка
Вышивка Презентация Путешествие в сказку золотая Хохлома
Презентация Путешествие в сказку золотая Хохлома 9 мая 1945 – День Победы
9 мая 1945 – День Победы Частотные преобразователи
Частотные преобразователи Презентация к уроку окружающего мира Чтобы путь был счастливым 3 класс
Презентация к уроку окружающего мира Чтобы путь был счастливым 3 класс Счет
Счет Электрические машины
Электрические машины Опытно-промышленное предприятие кучного выщелачивания на месторождении Лунное
Опытно-промышленное предприятие кучного выщелачивания на месторождении Лунное Советские военнопленные
Советские военнопленные Богатства, отданные людям. К. Э. Циолковский
Богатства, отданные людям. К. Э. Циолковский Характеристика предприятия Казахстан Темiр Жолы
Характеристика предприятия Казахстан Темiр Жолы Острое аномальное маточное кровотечение
Острое аномальное маточное кровотечение Молярный объем газов
Молярный объем газов Станционная система АиТ на железной дороге
Станционная система АиТ на железной дороге Цисар Маргарита - (К.1) - Красноарм. - Презентация
Цисар Маргарита - (К.1) - Красноарм. - Презентация Государственные должности и должности государственной службы
Государственные должности и должности государственной службы Презентация к интегрированной интеллектуальной игре по биологии и химииВодный мир. 8 класс.
Презентация к интегрированной интеллектуальной игре по биологии и химииВодный мир. 8 класс.