Содержание
- 2. Цель урока: обобщение, систематизация и углубление знаний о составе, классификации и свойствах оснований.
- 3. Основания - это… По структурной теории—это сложные вещества, в состав которых входят атомы металла, связанные с
- 4. Согласно протолитической теории Брёнстеда-Лоури основания-это молекулы или ионы, которые являются акцепторами катионов водорода Н+ протонов. Электронная
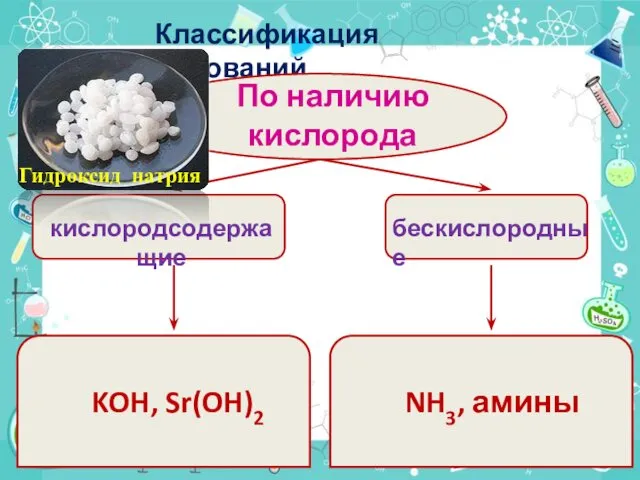
- 5. Классификация оснований По наличию кислорода кислородсодержащие бескислородные KOH, Sr(OH)2 NH3, амины Гидроксид натрия
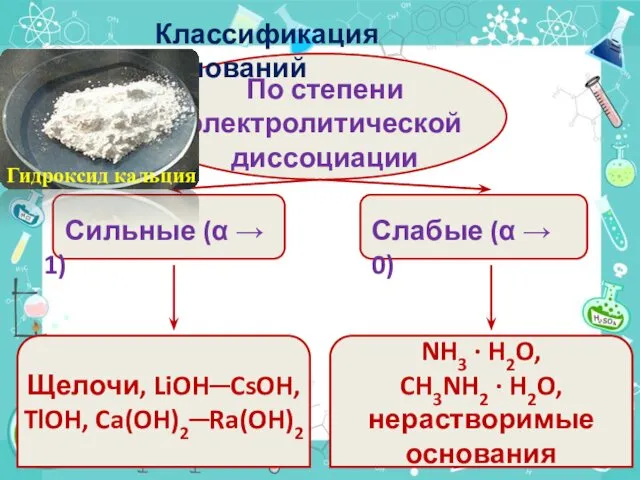
- 6. По степени электролитической диссоциации Сильные (α → 1) Слабые (α → 0) Щелочи, LiOH─CsOH, TlOH, Ca(OH)2─Ra(OH)2
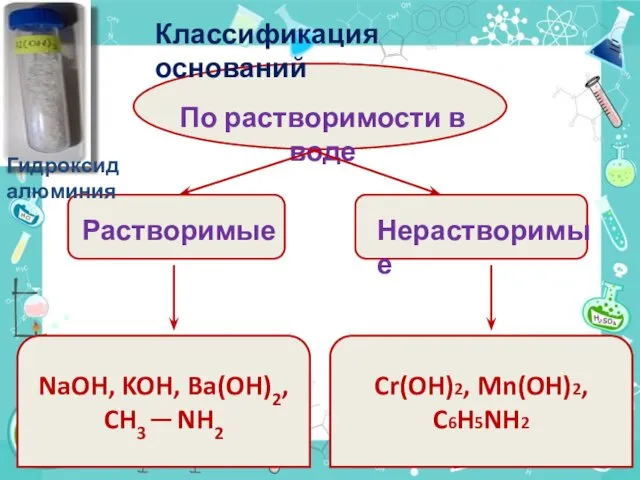
- 7. По растворимости в воде Растворимые Нерастворимые NaOH, KOH, Ba(OH)2, CH3 ─ NH2 Cr(OH)2, Mn(OH)2, C6H5NH2 Классификация
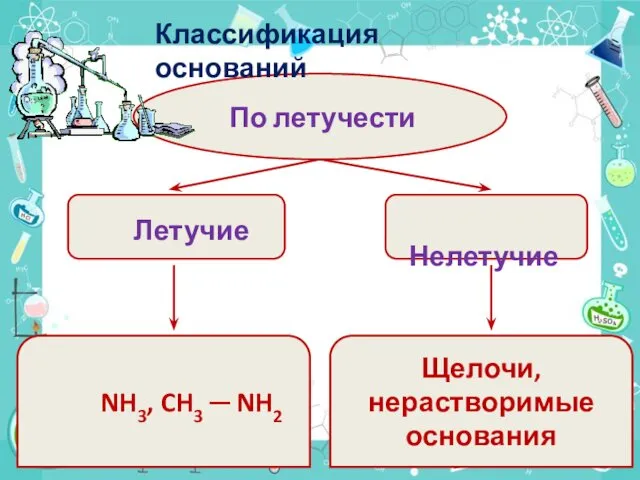
- 8. По летучести Летучие Нелетучие NH3, CH3 ─ NH2 Щелочи, нерастворимые основания Классификация оснований
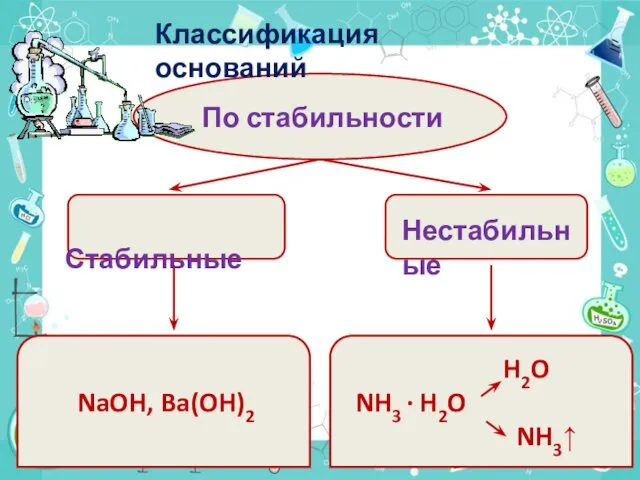
- 9. По стабильности Стабильные Нестабильные NaOH, Ba(OH)2 H2O NH3 · H2O NH3↑ Классификация оснований
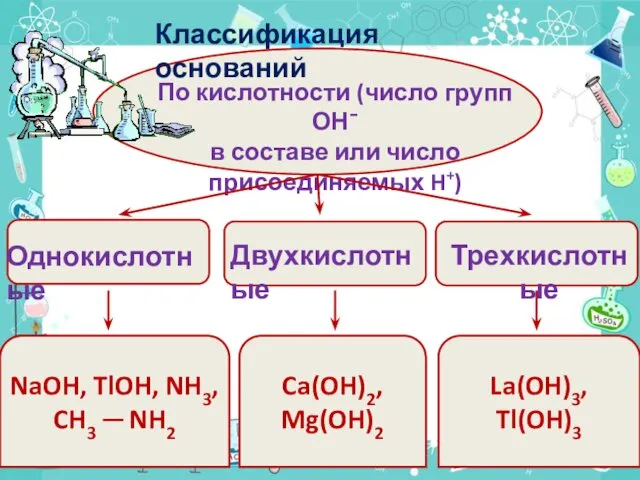
- 10. По кислотности (число групп ОН¯ в составе или число присоединяемых H+) NaOH, TlOH, NH3, CH3 ─
- 11. Свойства щелочей Водные растворы щелочей мылкие на ощупь, разъедают кожу, ткань. Изменяют окраску индикаторов: Лакмус –
- 12. Свойства щелочей 3)Взаимодействие с кислотами - реакция нейтрализации NH3 + HCl = NH4Cl CH3NH2 + HCl
- 13. Свойства щелочей Многокислотные основания могут давать в таких реакциях как средние так и основные соли
- 14. Свойства щелочей 4) Взаимодействие с кислотными оксидами Ca(OH)2 + CO2 = CaCO3 + H2O Са(ОН)2 +
- 15. 6) Взаимодействие с амфотерными гидроксидами и оксидами а) при сплавлении: 2NaOH + ZnO = Na2ZnO2 +
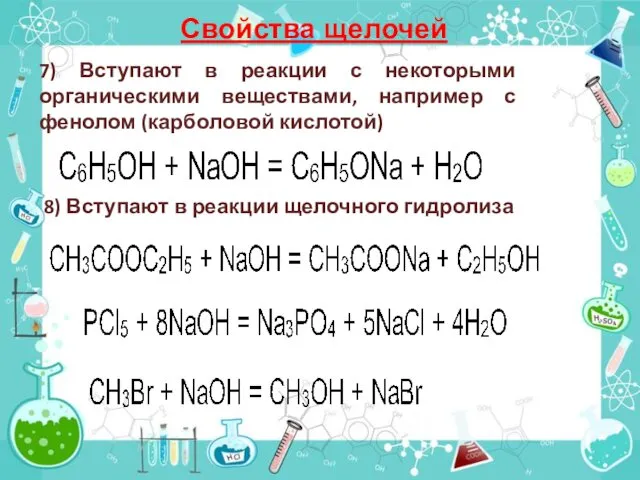
- 16. Свойства щелочей 7) Вступают в реакции с некоторыми органическими веществами, например с фенолом (карболовой кислотой) 8)
- 17. Разложение нерастворимых оснований при нагревании Cu(OH)2 = CuO + H2O 2Al(OH)3 = Al2O3 + 3H2O Свойства
- 18. Химические свойства аминов Основные свойства: а)СН3NH2 + H2O = СН3NH3OH Этиламин гидроксид метиламмония б)(С2Н5)2NH + HСl
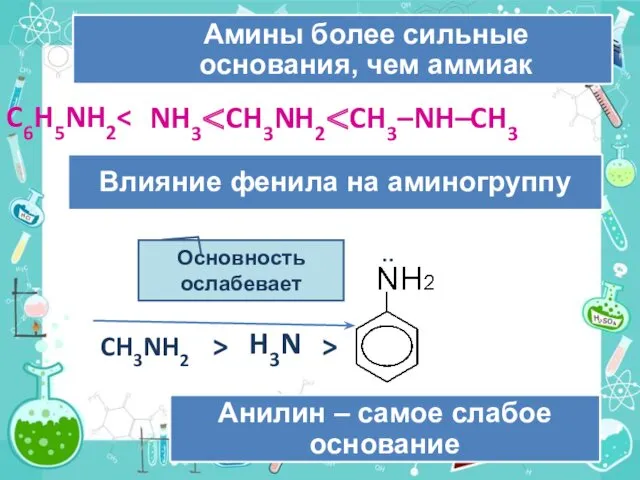
- 19. : CH3NH2 > H3N > Основность ослабевает NH3 C6H5NH2
- 20. Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому
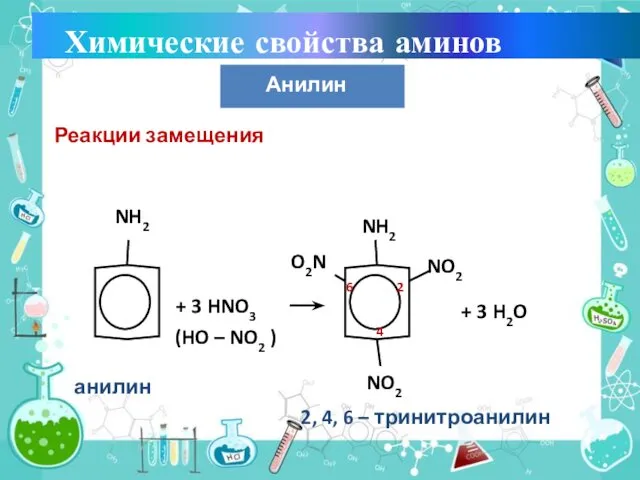
- 21. Реакции замещения NH2 + 3 HNO3 (HO – NO2 ) NH2 NO2 NO2 O2N + 3
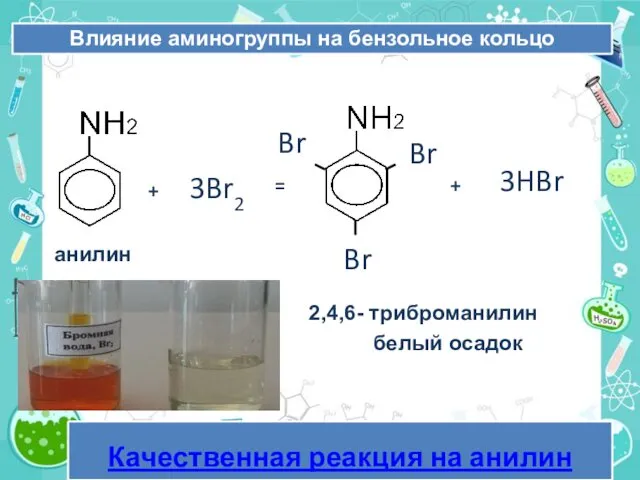
- 22. + 3Br2 = Br Br Br анилин 3HBr + 2,4,6- триброманилин белый осадокбелый
- 24. Скачать презентацию











 Внуковское, в районе деревни Пыхтино
Внуковское, в районе деревни Пыхтино Армения, государство на севере Азии
Армения, государство на севере Азии Soil erosion
Soil erosion Знаки препинания в конце предложения
Знаки препинания в конце предложения Кем иң көчле математик
Кем иң көчле математик Тепловое оборудование. Классификация теплового оборудования
Тепловое оборудование. Классификация теплового оборудования Мы и техника
Мы и техника Схемы холодильных установок
Схемы холодильных установок Модели организационных изменений
Модели организационных изменений Лучевая диагностика туберкулеза органов дыхания
Лучевая диагностика туберкулеза органов дыхания Целеполагание и планирование
Целеполагание и планирование Генетические задачи
Генетические задачи Адлер
Адлер Учебный мини-проект: поэтика числа пи
Учебный мини-проект: поэтика числа пи Теоретические основы информатики. Системы счисления
Теоретические основы информатики. Системы счисления Азқылтандылар класы
Азқылтандылар класы 20231203_kachestvo_zhizni_i_faktory_zdorovya
20231203_kachestvo_zhizni_i_faktory_zdorovya Ознакомление детей с правилами безопасного поведения на улицах и дорогах
Ознакомление детей с правилами безопасного поведения на улицах и дорогах Үгінді печенье
Үгінді печенье Машины и механизации доставки руды, конструктивные особенности и область применения
Машины и механизации доставки руды, конструктивные особенности и область применения Связь. Сфера обслуживания в России.
Связь. Сфера обслуживания в России. Урок в 10 классе Электронное и пространственное строение алканов
Урок в 10 классе Электронное и пространственное строение алканов 20231016_dary_oseni
20231016_dary_oseni Методика обучения чтению Николая Зайцева. Кубики Зайцева. Презентация для родителей и педагогов.
Методика обучения чтению Николая Зайцева. Кубики Зайцева. Презентация для родителей и педагогов. Основные принципы лечения алкоголизма. Купирование запоя, абстинентных состоянии
Основные принципы лечения алкоголизма. Купирование запоя, абстинентных состоянии Профсоюзная организация ОПФ МОУ СОШ с.Октябрьский городок в с. Куликовка
Профсоюзная организация ОПФ МОУ СОШ с.Октябрьский городок в с. Куликовка Работа мышц
Работа мышц Брак и семья. Семья и здоровый образ жизни человека
Брак и семья. Семья и здоровый образ жизни человека