Содержание
- 2. Ковалентная связь σ-связь (перекрытие происходит вдоль оси, соединяющей ядра атомов) перекрываются: s-s-облака, s-p-облака, p-p-облака. Всегда одинарная
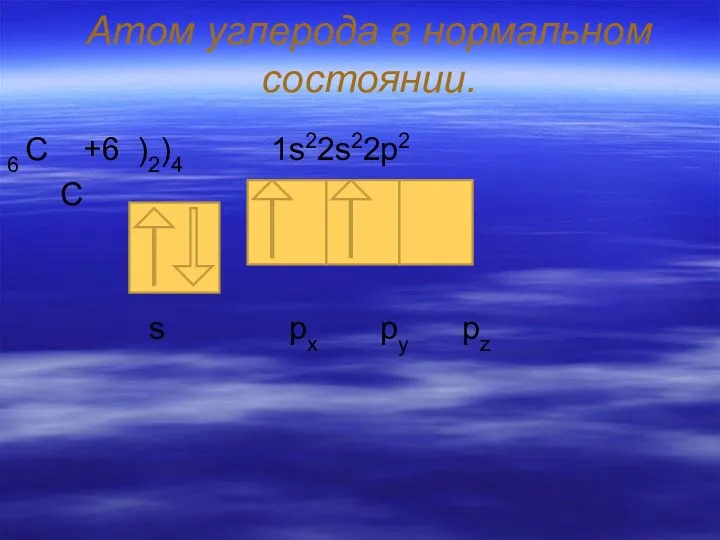
- 3. Атом углерода в нормальном состоянии. 6 С +6 )2)4 1s22s22p2 C s px py pz
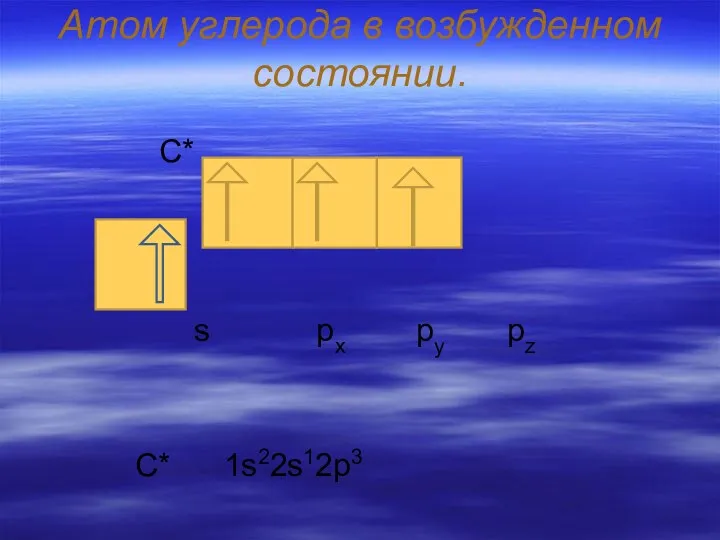
- 4. Атом углерода в возбужденном состоянии. C* s px py pz C* 1s22s12p3
- 5. Гибридизация - это процесс усреднения (выравнивания) электронных облаков по форме и энергии.
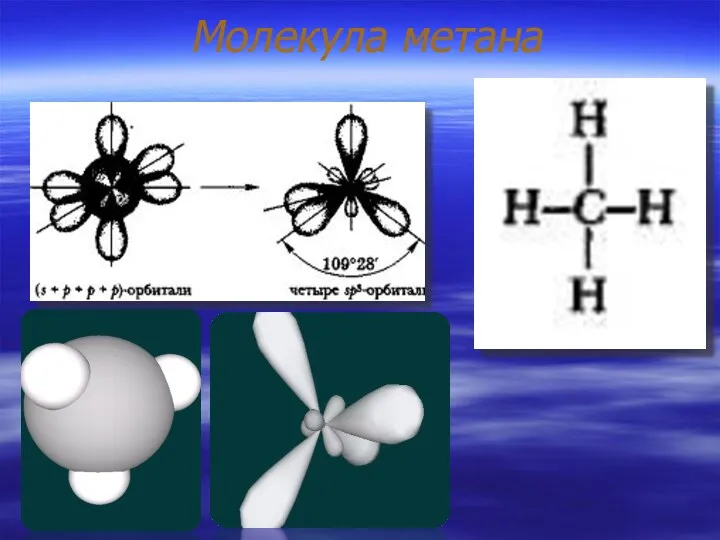
- 6. Молекула метана
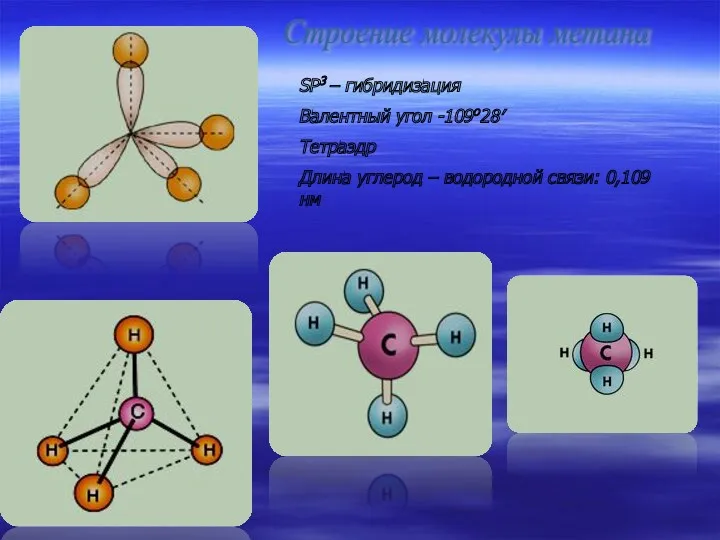
- 7. Строение молекулы метана SР3 – гибридизация Валентный угол -109о28′ Тетраэдр Длина углерод – водородной связи: 0,109
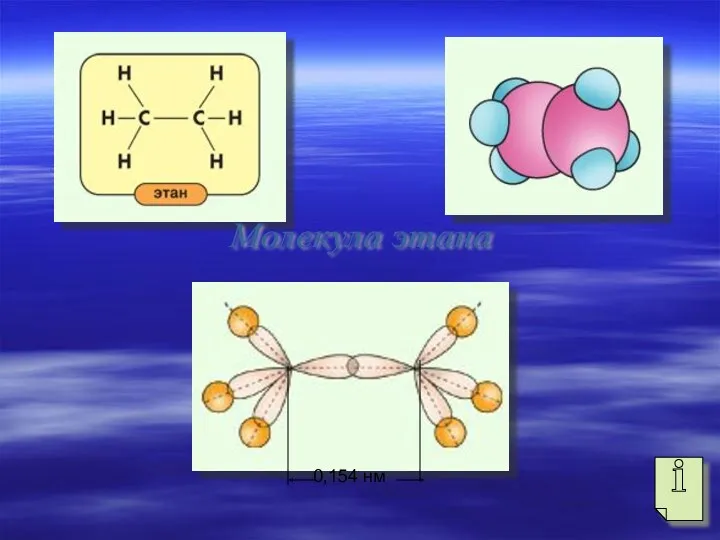
- 8. 0,154 нм Молекула этана
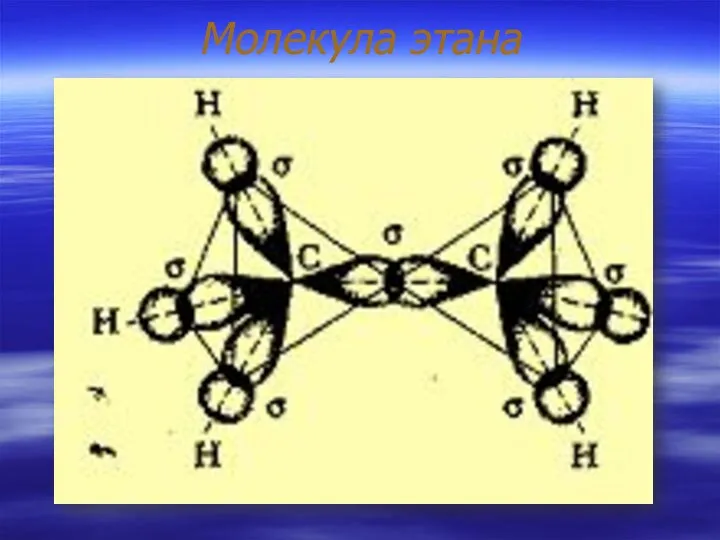
- 9. Молекула этана
- 10. Характеристики связей В молекуле этана два атома углерода находятся в состоянии sp3-гибридизации. Образуется семь ковалентных σ-связей,
- 11. Модель молекулы пентана Алканы с большим числом атомов углерода имеют зигзагообразное строение
- 12. Число гибридных орбиталей равно числу исходных. Гибридные обитали образуют только σ-связи. Гибридизации подвергаются электронные орбитали с
- 14. Скачать презентацию





 Свет и цвет в фотографии
Свет и цвет в фотографии Вимірювання обертального моменту валу електродвигуна на основі тензорезистора
Вимірювання обертального моменту валу електродвигуна на основі тензорезистора Структуры осадочных пород
Структуры осадочных пород гр.Улыбка вторник 14.04
гр.Улыбка вторник 14.04 Презентация: Использование информационно-просветительских форм работы с родителями по правилам дорожного движения
Презентация: Использование информационно-просветительских форм работы с родителями по правилам дорожного движения Проект организации перевалки сельскохозяйственных грузов Генезис
Проект организации перевалки сельскохозяйственных грузов Генезис Презентация Тула - моя малая Родина
Презентация Тула - моя малая Родина Воспитательный потенциал современной семьи
Воспитательный потенциал современной семьи Подготовительный этап коррекционно-логопедической работы по преодолению нарушений произношения звуков Х и Х'
Подготовительный этап коррекционно-логопедической работы по преодолению нарушений произношения звуков Х и Х' Дети-герои Великой Отечественной войны
Дети-герои Великой Отечественной войны Клиническая трансфузиология
Клиническая трансфузиология Радиостанция комплекса Vertex VX-4200. (Тема 4.7)
Радиостанция комплекса Vertex VX-4200. (Тема 4.7) Презентация к уроку по теме Природные ресурсы Западной Сибири (8 класс)
Презентация к уроку по теме Природные ресурсы Западной Сибири (8 класс) A_B_klassy_01_03_2021
A_B_klassy_01_03_2021 Аппаратные и программные средства видеонаблюдения
Аппаратные и программные средства видеонаблюдения Растворы. Растворимость
Растворы. Растворимость Особенности функциональной специализации полушарий у детей с ОНР
Особенности функциональной специализации полушарий у детей с ОНР ПрезентацияСвященные сооружения
ПрезентацияСвященные сооружения Безусловная оптимизация методом классического математического анализа. Определение оптимального времени пребывания
Безусловная оптимизация методом классического математического анализа. Определение оптимального времени пребывания Ах, эти кошки… Викторина
Ах, эти кошки… Викторина МОЯ ВИЗИТНАЯ КАРТОЧКА
МОЯ ВИЗИТНАЯ КАРТОЧКА Мікропроцесорні системи
Мікропроцесорні системи презентация 70 лет Сталинградской битве
презентация 70 лет Сталинградской битве Презентация. История герба города Погара.
Презентация. История герба города Погара. Виртуальная экскурсия по городу Псков. Псковский Кром (Кремль)
Виртуальная экскурсия по городу Псков. Псковский Кром (Кремль) Пищеварение в ротовой полости
Пищеварение в ротовой полости Хамантова Г. Ю. МБУ ДО Полазненская ДШИ, Рециклинг
Хамантова Г. Ю. МБУ ДО Полазненская ДШИ, Рециклинг Макет рабочей программы воспитания при разработке и обновлении образовательных программ среднего профессионального образования
Макет рабочей программы воспитания при разработке и обновлении образовательных программ среднего профессионального образования