Содержание
- 2. Растворы - это однородные (гомогенные) системы переменного состава.
- 3. Количество (масса) растворенного вещества в единице массы или объема раствора называют концентрацией раствора. Способы выражения концентрации
- 4. Задача. Вычислите массы соли и воды, необходимые для приготовления 750 г 20%-ного раствора NH4Cl. Решение. Масса
- 5. Растворимость – это способность одного вещества растворяться в другом при заданных условиях. Количественно она выражается коэффициентом
- 7. Кривые растворимости
- 8. Химические реакции в растворах NaOH + HCl = NaCl + H2O Закон эквивалентов: n(NaOH) = n(HCl)
- 9. Бюретка Титрование – медленное смешивание растворов до достижения точки эквивалентности Точка эквивалентности – момент равенства числа
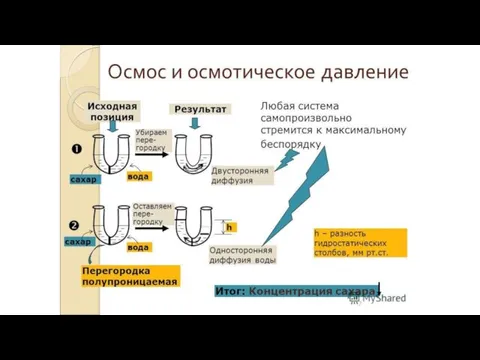
- 11. Свойства растворов Общие (коллигативные) свойства – зависят только от концентрации растворов и не зависят от природы
- 22. Особые свойства растворов 1. Электролитическая диссоциация в растворах
- 23. Степень диссоциации: α = Nдис / Nобщ = Сдис / Собщ, где N – число молекул;
- 24. Реакции обмена в растворах
- 26. Амфотерные электролиты могут участвовать в химических реакциях как в роли основания, так и в роли кислоты.
- 27. Теория сильных электролитов Активность – кажущаяся концентрация ионов, проявляющаяся в их взаимодействии: a = f⋅C (
- 29. Теория слабых электролитов Диссоциация слабых электролитов - процесс обратимый и ступенчатый, для него устанавливается состояние химического
- 30. Диссоциация слабого бинарного электролита Если начальная концентрация электролита равна С, а степень диссоциации α, Закон разбавления
- 31. Добавление в раствор слабых электролитов одноименных ионов вызывает смещение равновесия реакции диссоциации в сторону ее уменьшения
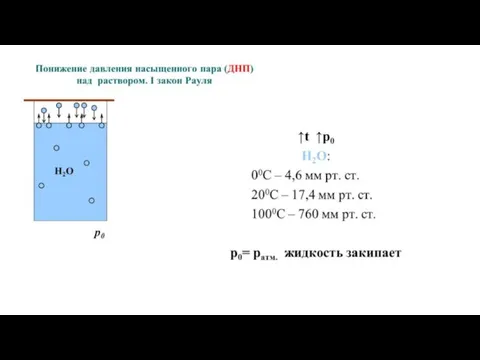
- 32. Электролитическая диссоциация воды [H2O]= n(H2O)/1л = 1000/18 = 55,5 моль/л (ионное произведение воды)
- 33. Водородный показатель, рН: рН = –lg[H+] рОН = –lg[ОH-] Гидроксильный показатель, рОН: рН + рОН =
- 34. Кислотно-основные индикаторы вещества, меняющее окраску в определенной области значения pH раствора.
- 37. Гетерогенные равновесия растворов с осадком [Ca2+], [CO32−] - равновесные концентрации ионов в растворе; [CaCO3] - концентрация
- 38. Связь между произведением растворимости и растворимостью осадка Обозначим молярную растворимость вещества через “S” . Тогда раствор
- 39. В присутствии одноименных ионов равновесие смещается в сторону образования осадка (эффект одноименного иона). В присутствии сильных
- 40. Условие образования осадка: произведение концентраций ионов в растворе должно быть больше, чем величина произведения растворимости данного
- 44. Скачать презентацию



























![Электролитическая диссоциация воды [H2O]= n(H2O)/1л = 1000/18 = 55,5 моль/л (ионное произведение воды)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/36356/slide-31.jpg)
![Водородный показатель, рН: рН = –lg[H+] рОН = –lg[ОH-] Гидроксильный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/36356/slide-32.jpg)



![Гетерогенные равновесия растворов с осадком [Ca2+], [CO32−] - равновесные концентрации](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/36356/slide-36.jpg)





 Компания Март. Организация праздника
Компания Март. Организация праздника Австралия
Австралия Праздник Пасха
Праздник Пасха ОСАГО и перспективы его совершенствования
ОСАГО и перспективы его совершенствования Желаемые объекты Чкаловского парка
Желаемые объекты Чкаловского парка Национально-психологические особенности представителей разных народов России
Национально-психологические особенности представителей разных народов России отбасым алтын ұям ІІ бөлім
отбасым алтын ұям ІІ бөлім Урок по теме: Физические и химические явления 7 класс (презентация).
Урок по теме: Физические и химические явления 7 класс (презентация). Товарная информация и её виды
Товарная информация и её виды Презентация о жизни И.А.Крылова
Презентация о жизни И.А.Крылова Пезентация Праздник белых журавлей
Пезентация Праздник белых журавлей С Новым годом(презентация ученицы)
С Новым годом(презентация ученицы) Урок-38
Урок-38 Marker beacon system
Marker beacon system Устройство токарного станка СТД-120м
Устройство токарного станка СТД-120м Кардиалгический синдром. Лечение больных ИБС в амбулаторных условиях
Кардиалгический синдром. Лечение больных ИБС в амбулаторных условиях Урок по теме : Кислоты. Все познается в сравнении 8 класс
Урок по теме : Кислоты. Все познается в сравнении 8 класс Типы химических реакций
Типы химических реакций Социальная информатика
Социальная информатика Викторина Олимпийские игры
Викторина Олимпийские игры Праздник праздников. Пасха
Праздник праздников. Пасха Литературная баллада Западной Европы. Роберт Бернс Джон Ячменное Зерно
Литературная баллада Западной Европы. Роберт Бернс Джон Ячменное Зерно Презентация для воспитателей Мостик взаимопонимания между родителями и воспитателями ДОУ
Презентация для воспитателей Мостик взаимопонимания между родителями и воспитателями ДОУ День Святой Троицы (Пятидесятница)
День Святой Троицы (Пятидесятница) Вещества в окружающем мире и их использование человеком.
Вещества в окружающем мире и их использование человеком. Программа обучения сотрудников активных продаж. Компания Гольфстрим
Программа обучения сотрудников активных продаж. Компания Гольфстрим Синдром задержки внутриутробного развития плода
Синдром задержки внутриутробного развития плода Биологическое действие радиации
Биологическое действие радиации