Содержание
- 2. 1. Понятие о непредельных углеводородах. 2. Гомологический ряд алкенов. 3. Изомерия и номенклатура алкенов. 4. Получение
- 3. Непредельные углеводороды – это углеводороды, в молекулах которых между атомами углерода наряду с одинарными связями имеются
- 4. 2) Гомологический ряд алкенов.
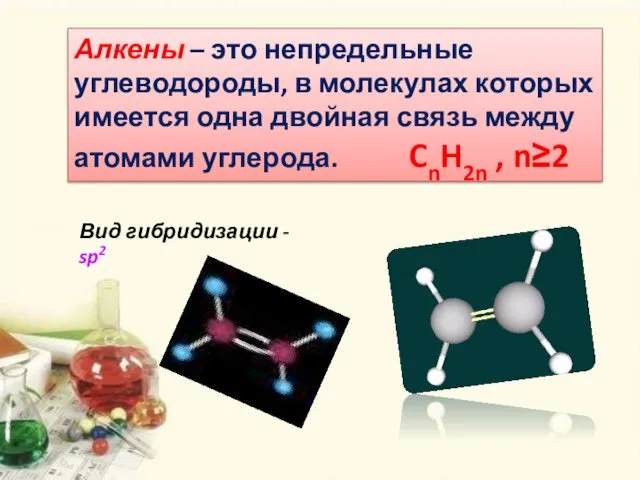
- 5. Алкены – это непредельные углеводороды, в молекулах которых имеется одна двойная связь между атомами углерода. CnH2n
- 6. 3. Изомерия и номенклатура алкенов. Алгоритм составления названия алкена: В качестве главной выбрать самую длинную у/в
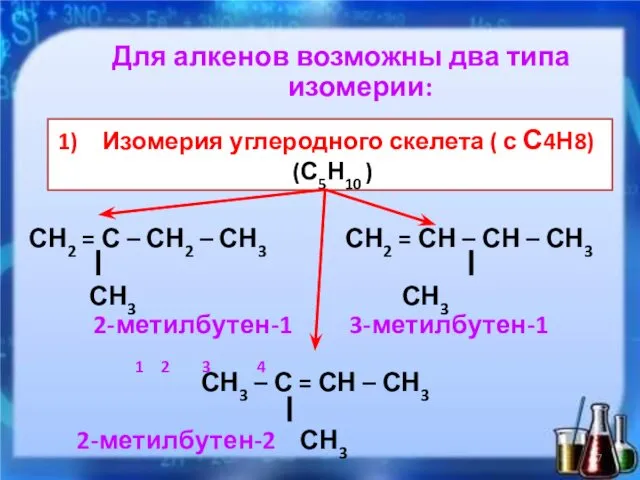
- 7. Для алкенов возможны два типа изомерии: 1-ый тип: структурная изомерия: СН2 = С – СН2 –
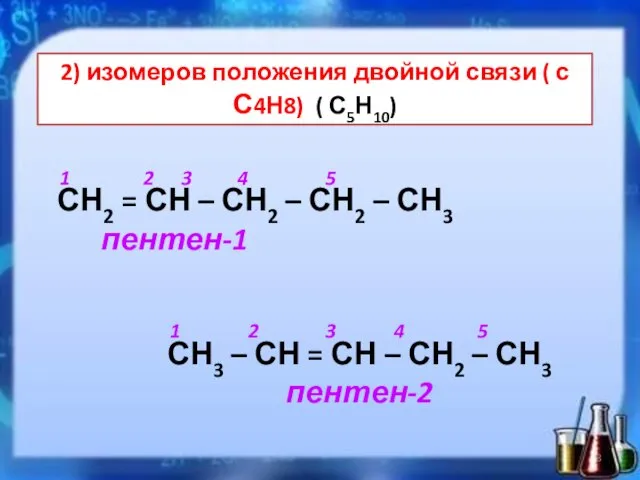
- 8. 2) изомеров положения двойной связи ( с С4Н8) ( С5Н10) 1 2 3 4 5 СН2
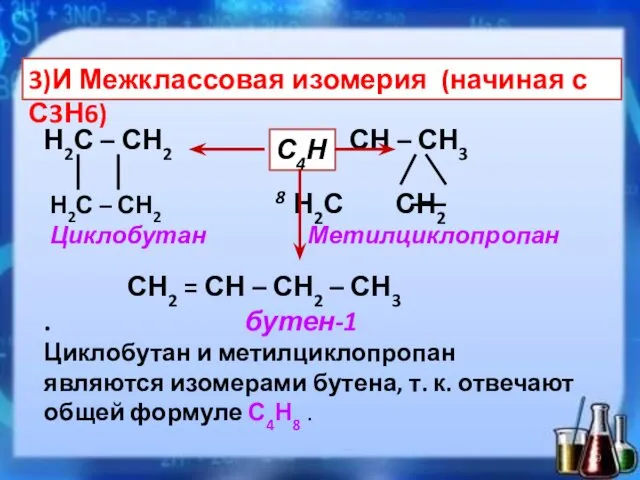
- 9. 3)И Межклассовая изомерия (начиная с С3Н6) Н2С – СН2 СН – СН3 Н2С – СН2 Н2С
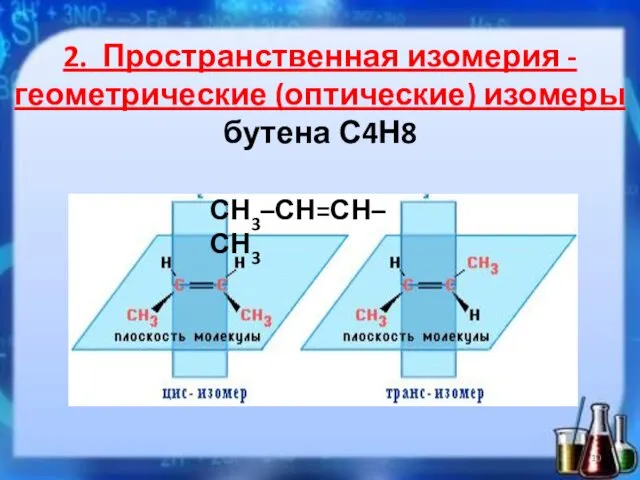
- 10. 2. Пространственная изомерия -геометрические (оптические) изомеры бутена С4Н8 СН3–СН=СН–СН3
- 11. 4. Способы получение алкенов. Промышленные 1)Термический крекинг алканов С10Н22 → C5H12 + C5H10 декан пентан пентен
- 12. 5. Физические свойства. Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях. С увеличением
- 13. 7. Применение алкенов
- 16. Скачать презентацию








 Релігія та вірування. Політеїзм. Головні боги Єгипта
Релігія та вірування. Політеїзм. Головні боги Єгипта СПЕШИ ТВОРИТЬ ДОБРО.3 декабря - Международный день инвалидов
СПЕШИ ТВОРИТЬ ДОБРО.3 декабря - Международный день инвалидов Новый порядок аттестации педагогических работников
Новый порядок аттестации педагогических работников Поколения. Взаимоотношение поколений
Поколения. Взаимоотношение поколений Использование вербальных и невербальных средств общения для достижения эффективного взаимодействия
Использование вербальных и невербальных средств общения для достижения эффективного взаимодействия Методическая разработка презентации: Развитие фонематического анализа и синтеза
Методическая разработка презентации: Развитие фонематического анализа и синтеза Пищеварение в тонкой кишке (окончание): гидролиз, всасывание
Пищеварение в тонкой кишке (окончание): гидролиз, всасывание Презентация кабинета
Презентация кабинета Кредиттік оқыту жүйесі
Кредиттік оқыту жүйесі Оплодотворение. Эмбриогенез
Оплодотворение. Эмбриогенез Фотоальбом
Фотоальбом primer_otchet
primer_otchet Город – герой Ленинград
Город – герой Ленинград ОРИЕНТИРОВАНИЕ НА МЕСТНОСТИ. АЗИМУТ.
ОРИЕНТИРОВАНИЕ НА МЕСТНОСТИ. АЗИМУТ. Тема Великой Отечественной войны в советской литературе
Тема Великой Отечественной войны в советской литературе Изображение на координатной плоскости множества решений уравнений и неравенств с двумя переменными и их систем
Изображение на координатной плоскости множества решений уравнений и неравенств с двумя переменными и их систем Покажи свое настроение. Больной друг
Покажи свое настроение. Больной друг Сценарий Мама, папа, я - спортивная семья
Сценарий Мама, папа, я - спортивная семья Процессы прямого получения железа из руд. Производство стали. Производство заготовок
Процессы прямого получения железа из руд. Производство стали. Производство заготовок Водный транспорт. Морской и речной транспорт
Водный транспорт. Морской и речной транспорт Рекомендации для учителей по построению урока с позиций системно-деятельностно подхода
Рекомендации для учителей по построению урока с позиций системно-деятельностно подхода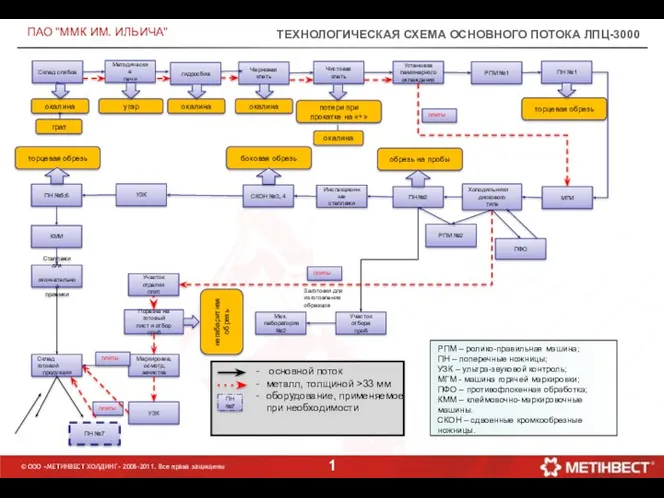 Технологическая схема основного потока ЛПЦ-3000
Технологическая схема основного потока ЛПЦ-3000 Организация семейной творческой выставки Дары осени как условие художественно-эстетического развития детей дошкольного возраста.
Организация семейной творческой выставки Дары осени как условие художественно-эстетического развития детей дошкольного возраста. Среднее арифметическое чисел
Среднее арифметическое чисел Воспитание основ здорового образа жизни у дошкольников
Воспитание основ здорового образа жизни у дошкольников Инкарнационные кресты. Цель уникальности
Инкарнационные кресты. Цель уникальности Презентация 2-й младшей группы Звездочка
Презентация 2-й младшей группы Звездочка Reported Speech in statements
Reported Speech in statements