Содержание
- 2. H2Y2- + Me2+ = MeY2- + 2H+. Со всеми ионами металлов (кроме одновалентных) ЭДТА реагирует в
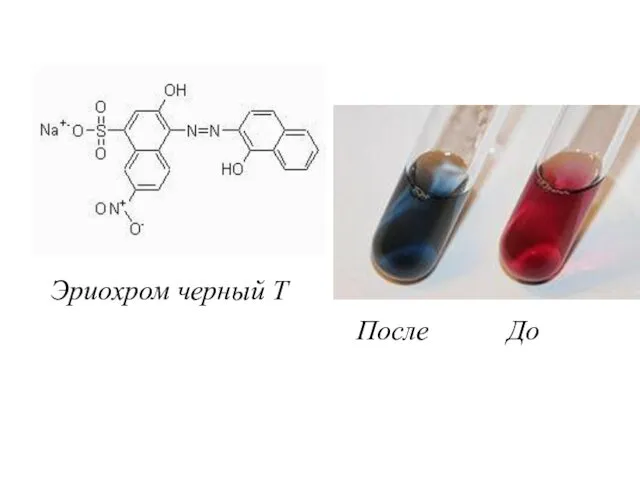
- 3. Эриохром черный Т После До
- 5. Шкала жесткости Жесткость воды количественно выражают суммой миллиграмм-эквивалентов ионов кальция и магния, содержащихся в 1 л
- 6. Методы окислительно-восстановительного титрования методы окислительно-восстановительного титрования классифицируют следующим образом: перманганатометрия – рабочий раствор перманганата калия (KMnO4),
- 7. Перманганат калия
- 8. Цвет перманганата калия 1 2 3
- 9. KMnO4 Калия перманганат не относится к первичным стандартам, поэтому раствор титранта по точной навеске приготовить нельзя.
- 10. Соль Мора (NH4)2Fe(SO4)2∙6H2O
- 12. Скачать презентацию








 Мобильные устройства и приложение
Мобильные устройства и приложение Новогодние программы от Арктур Шоу. 10 лет мы вместе с вами! А теперь и в Сочи!
Новогодние программы от Арктур Шоу. 10 лет мы вместе с вами! А теперь и в Сочи! Презентация Музыка, Фиолетовый Лес (Аюгина Е.В.)
Презентация Музыка, Фиолетовый Лес (Аюгина Е.В.)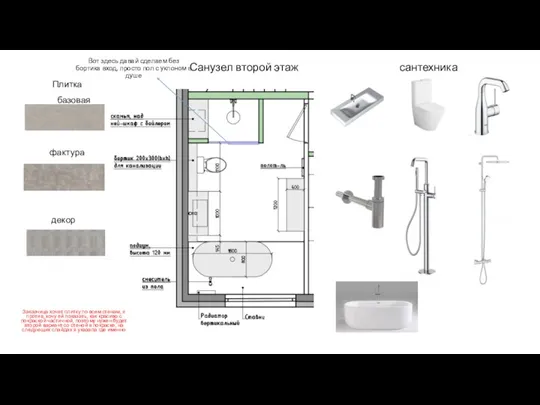 Санузлы. Концепция
Санузлы. Концепция Kazan is the capital of the Republic of Tatarstan
Kazan is the capital of the Republic of Tatarstan Конкурс на лучший видеоролик о деятельности районных и первичных профорганизаций Профсоюз в действии
Конкурс на лучший видеоролик о деятельности районных и первичных профорганизаций Профсоюз в действии Interesting cultural facts (echo questions)
Interesting cultural facts (echo questions) Методы и способы измерения вибрации. Вибрационная диагностика
Методы и способы измерения вибрации. Вибрационная диагностика Первоцветы
Первоцветы Структуры данных, алгоритмы, коллекции
Структуры данных, алгоритмы, коллекции Методы географических исследований. Развитие географической науки. 7 класс
Методы географических исследований. Развитие географической науки. 7 класс Сертификация услуг общественного питания
Сертификация услуг общественного питания Формы рельефа суши
Формы рельефа суши Презентация кроссворда Светофор
Презентация кроссворда Светофор Тепловое оборудование. Классификация теплового оборудования
Тепловое оборудование. Классификация теплового оборудования Проектная деятельность в детском саду
Проектная деятельность в детском саду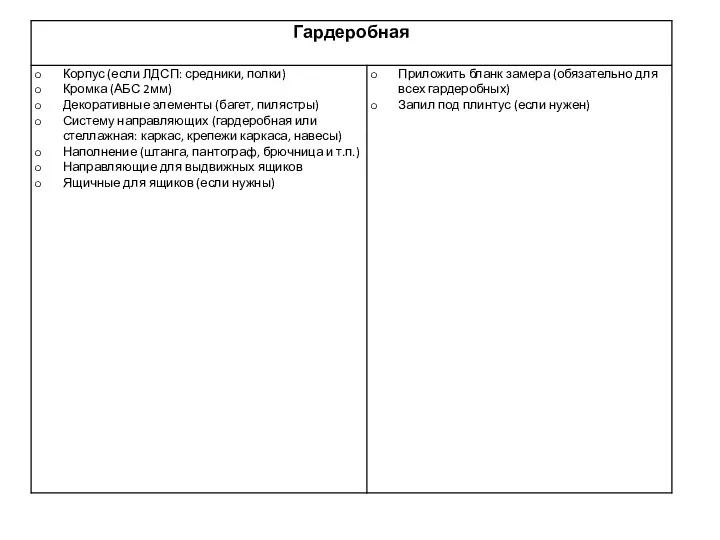 Гардеробная. Бланк замера
Гардеробная. Бланк замера Презентация Композиторы Кубани. В.Г.Захарченко
Презентация Композиторы Кубани. В.Г.Захарченко Аргентина
Аргентина игровые навыки
игровые навыки Венесуела. Візитна картка
Венесуела. Візитна картка Образовательная программа детского объединения
Образовательная программа детского объединения Современные информационные технологии, используемые в бизнес-планировании. Тема 10
Современные информационные технологии, используемые в бизнес-планировании. Тема 10 Место предпринимательского права в правовой системе РФ
Место предпринимательского права в правовой системе РФ В.Шекспир Ромео и Джульетта
В.Шекспир Ромео и Джульетта Население Австралии. Урок 28
Население Австралии. Урок 28 Кристаллдық және аморфтық күй
Кристаллдық және аморфтық күй Счетчики. Асинхронные счетчики
Счетчики. Асинхронные счетчики