Содержание
- 2. Окислительно-восстановительные процессы осуществляются с переносом электронов от одного реагирующего вещества к другому и сопровождаются изменением степеней
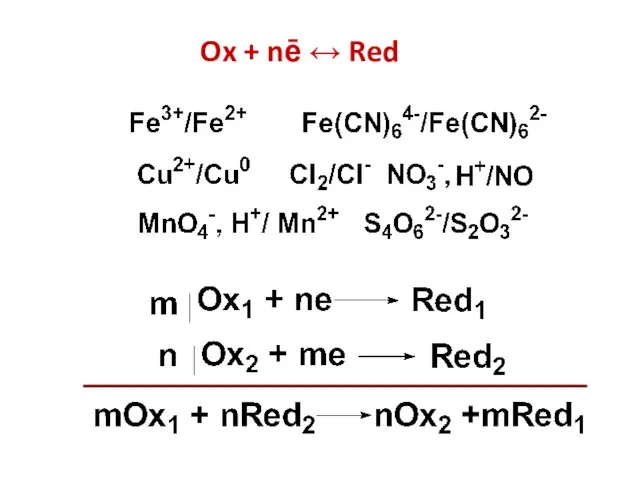
- 3. Ox + nē ↔ Red
- 4. Мера окислительно-восстановительной способности редокс-пары – окислительно-восстановительный потенциал полуреакции Ox + nē ↔ Red Измерить можно только
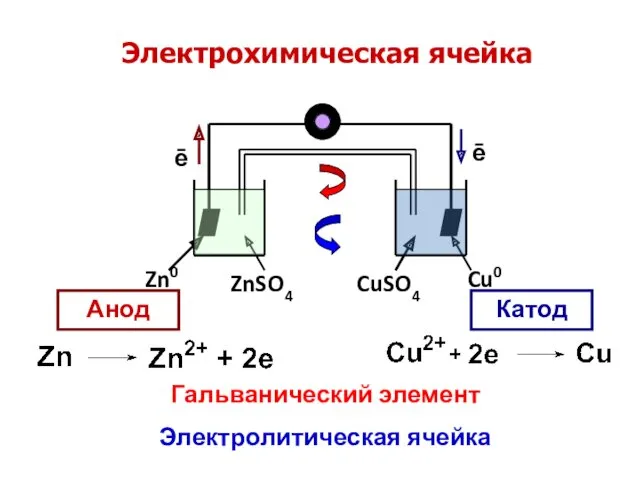
- 5. Электрохимическая ячейка ZnSO4 Zn0 CuSO4 Cu0 Анод Катод ē ē Гальванический элемент Электролитическая ячейка
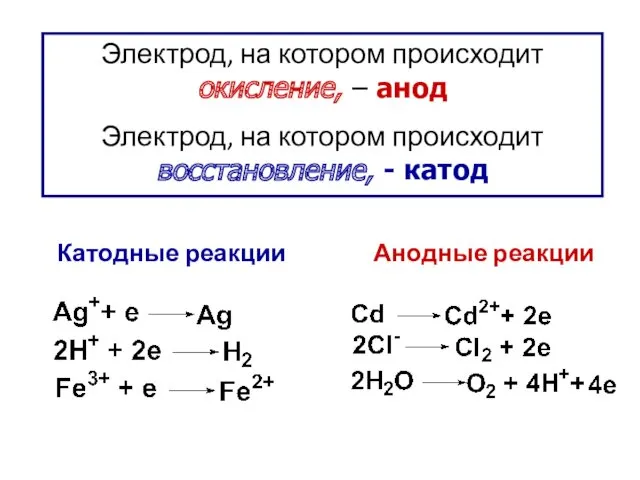
- 6. Электрод, на котором происходит окисление, – анод Электрод, на котором происходит восстановление, - катод Катодные реакции
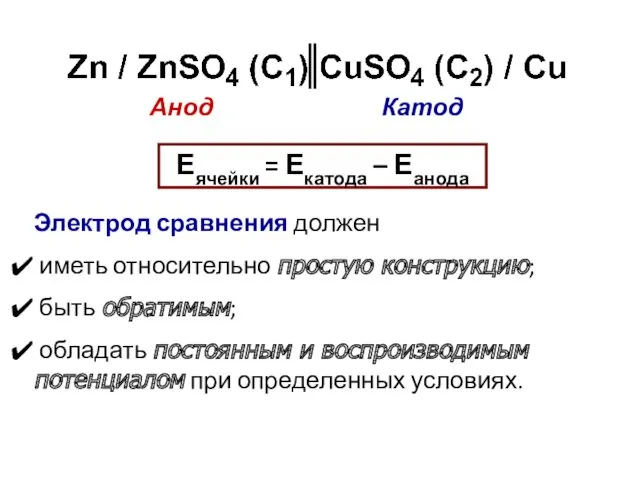
- 7. Анод Катод Еячейки = Екатода – Еанода Электрод сравнения должен иметь относительно простую конструкцию; быть обратимым;
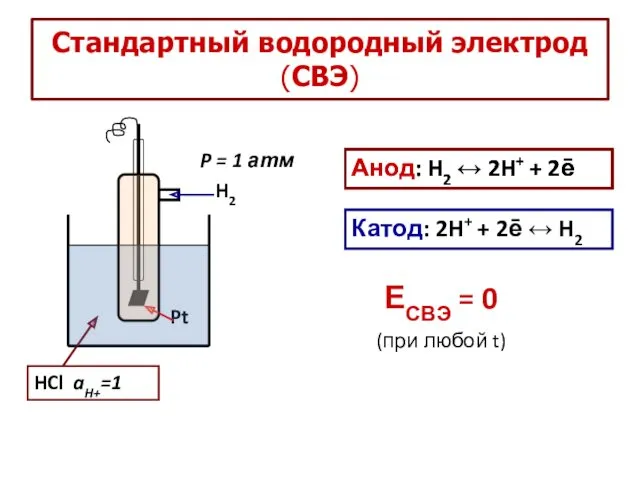
- 8. Стандартный водородный электрод (СВЭ) HCl aH+=1 Pt H2 Анод: H2 ↔ 2H+ + 2ē Катод: 2H+
- 9. Все реакции записывают в форме полуреакции восстановления. За знак потенциала принимают действительный знак получаемого электрода относительно
- 10. «-» означает, что окислитель данной пары сильнее, чем Н+; СВЭ - анод: H2 ↔ 2H+ +
- 11. Уравнение Нернста Ox + nē ↔ Red R – молярная газовая постоянная, 8,314 Дж.моль-1.К-1; T –
- 12. I=0, γ=1, α=1 При 250С Стандартный электродный потенциал – это равновесный потенциал полуреакции при активностях всех
- 13. I≠0, γ≠1, α≠1 aOx = COx· γOx·αOx aRed = CRed· γRed·αRed Формальный электродный потенциал – равновесный
- 14. Факторы, влияющие на Е0’ рН среды Ox + nē + mH+ ↔ Red + m/2 H2O
- 15. Конкурирующие реакции образования малорастворимых соединений Ox + A ↔ OxA OxA + nē ↔ Red +
- 16. Конкурирующие реакции комплексообразования Ox + mL ↔ OxLm OxLm + nē ↔ Red βm = [OxLm]/[Ox][L]m
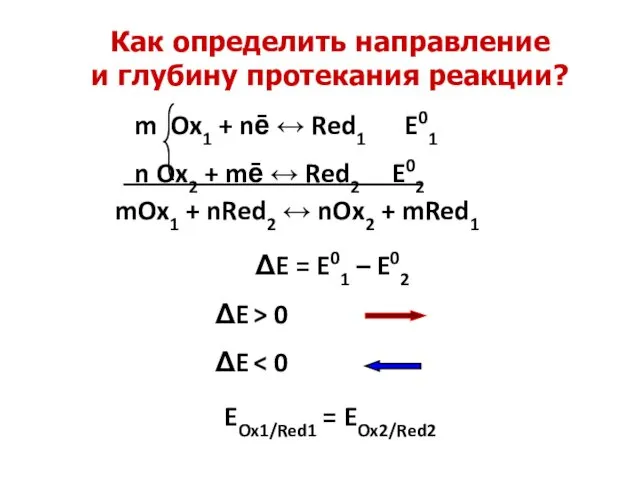
- 17. Как определить направление и глубину протекания реакции? m Ox1 + nē ↔ Red1 E01 n Ox2
- 18. Kравн > 1 Kравн На направление и глубину протекания реакций влияют все факторы, изменяющие Е0’Ox/Red Обратите
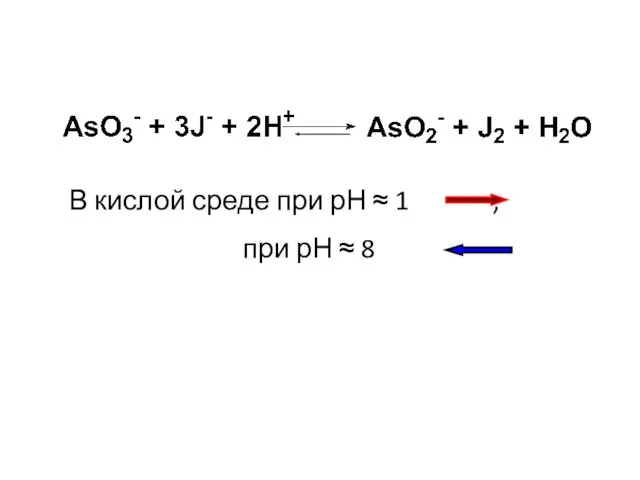
- 19. В кислой среде при рН ≈ 1 , при рН ≈ 8
- 20. Применение окислительно-восстановительных реакций в анализе Для переведения анализируемых объектов в растворимое состояние Для разделения элементов Отделение
- 22. Скачать презентацию












 Презентация. Десять заповедей Януша Корчака для родителей
Презентация. Десять заповедей Януша Корчака для родителей Вербальные и невербальные коммуникации
Вербальные и невербальные коммуникации Каталитикалық риформинг қондырғысының реакторлар блогы
Каталитикалық риформинг қондырғысының реакторлар блогы Общий наркоз при лечении кариеса зубов у детей
Общий наркоз при лечении кариеса зубов у детей Urban style
Urban style Разработка автоматизированной системы управления технологическим процессом получения горячей сетевой воды
Разработка автоматизированной системы управления технологическим процессом получения горячей сетевой воды Презентация Кузьма Минин - великий гражданин России.
Презентация Кузьма Минин - великий гражданин России. Родовые понятия и методологические основания социологии Эмиля Дюркгейма в цитатах
Родовые понятия и методологические основания социологии Эмиля Дюркгейма в цитатах На звездной орбите. История праздника 12 апреля
На звездной орбите. История праздника 12 апреля Цветная металлургия
Цветная металлургия Внеклассное мероприятие в начальных классах к 8 марта Милые,добрые, нежные- ВАМ!
Внеклассное мероприятие в начальных классах к 8 марта Милые,добрые, нежные- ВАМ! Формы глагола Be в настоящем простом времени. GRAMMAR
Формы глагола Be в настоящем простом времени. GRAMMAR Палеозойская эра
Палеозойская эра 20230713_05._tehnicheskoe_konstruirovanie_i_modelirovanie
20230713_05._tehnicheskoe_konstruirovanie_i_modelirovanie Режимы работы редактора Word
Режимы работы редактора Word Общая характеристика спортивной подготовки
Общая характеристика спортивной подготовки Презентация: Столица моей родины - Москва
Презентация: Столица моей родины - Москва Упражнения для развития памяти и внимания на уроках иностранного языка
Упражнения для развития памяти и внимания на уроках иностранного языка Российский университет дружбы народов Комиссия по связям с общественностью
Российский университет дружбы народов Комиссия по связям с общественностью Презентация к проекту Что в имени моем...
Презентация к проекту Что в имени моем... Внеклассные мероприятия
Внеклассные мероприятия Настоящее совершенное время Present Perfect Tense
Настоящее совершенное время Present Perfect Tense Творчество ненецкого художника К.Л.Панкова. Презентация
Творчество ненецкого художника К.Л.Панкова. Презентация Создание программы
Создание программы Коммунальная техника ЖКХ
Коммунальная техника ЖКХ Ядерный реактор как источник ионизирующего излучения. Решение задач
Ядерный реактор как источник ионизирующего излучения. Решение задач Магия намерения. Мужской и женский способ достижения желаемого
Магия намерения. Мужской и женский способ достижения желаемого Функциональные элементы САР ЭПС: исполнительные и управляющие элементы
Функциональные элементы САР ЭПС: исполнительные и управляющие элементы