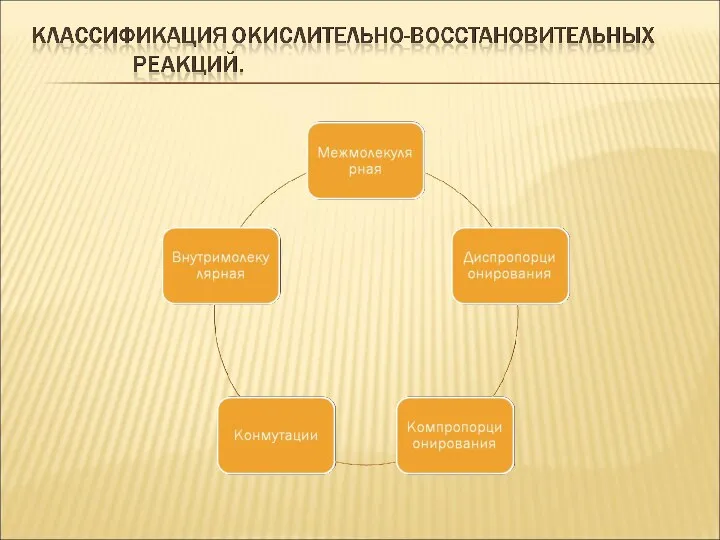
Слайд 6

Группа окислителей Химические элементы Примеры веществ
Электрический ток на аноде - -
Галогены
в высших положительных + 7 +7 +7
степенях окисления CI, Br, I НClO4, HBr04,HJO4
Галогены в промежуточных + 1 +3 +5 +5 +5
положительных степенях окисления CI, CI, Cl, Br, I. КClO3, HClO, NaBr03
Халькогены и другие неметаллы в +6 + 4 +5
положительных степенях окисления S, S, N H2S04, S02, HN03
Неметаллы – простые вещества 0 0 0 0 0
(нулевая степень окисления) F, С, О, S, Вг F2, Cl2, 03, 02, S, Br2
Неметаллы в промежуточных -1 -2
отрицательных степенях окисления O, N H202, Ba02, N2H4
Металлы в высших положительных + 7 +6 +4
степенях окисления Mn, Cr, Sn KMn04, K2Cr04, H2Cr207, SnCl4
Металлы в промежуточных + 2 +1 +2
положительных степенях окисления Fe, Cu, Sn FeCl2, Cu2Cl2, SnS04













 Полупроводниковые схемы памяти. (Лекция 14)
Полупроводниковые схемы памяти. (Лекция 14) Моя педагогическая династия.
Моя педагогическая династия. Экологические взаимодействия живых организмов
Экологические взаимодействия живых организмов Сложные предложения с различными видами связи (вводный урок). 9 класс
Сложные предложения с различными видами связи (вводный урок). 9 класс О подводных жителях
О подводных жителях Применение ИКТ в образовательном процессе
Применение ИКТ в образовательном процессе Бізнес-модель по реалізації хліба
Бізнес-модель по реалізації хліба Тема =Базовая форма =Треугольник=. Складывание фигур =Лисенок=Щенок=
Тема =Базовая форма =Треугольник=. Складывание фигур =Лисенок=Щенок= Внутреннее устройство ПК
Внутреннее устройство ПК Экскурсия Улицы родного села.
Экскурсия Улицы родного села. Проектно- исследовательская деятельность в экологическом образовании старших дошкольников
Проектно- исследовательская деятельность в экологическом образовании старших дошкольников Стратегическое планирование и технологии программно-целевого управления
Стратегическое планирование и технологии программно-целевого управления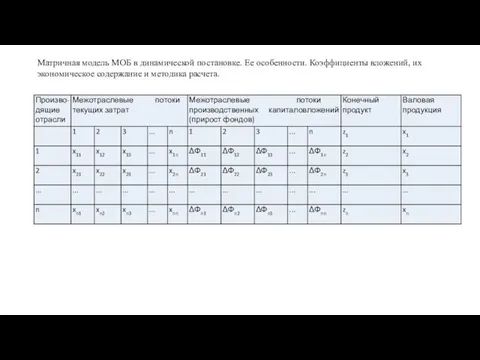 Матричная модель МОБ в динамической постановке
Матричная модель МОБ в динамической постановке Технология и организация производства продукции и услуг
Технология и организация производства продукции и услуг Диагностика, техническое обслуживание рулевого управления автомобиля ВАЗ-2107
Диагностика, техническое обслуживание рулевого управления автомобиля ВАЗ-2107 Отчет об участии в акции Всероссийский экологический урок Сделаем вместе!
Отчет об участии в акции Всероссийский экологический урок Сделаем вместе! Проект на тему Семья (средняя группа)
Проект на тему Семья (средняя группа) Cистема управления персоналом государственной и муниципальной службы
Cистема управления персоналом государственной и муниципальной службы Высокоточные системы навигации. Лекция №1.2
Высокоточные системы навигации. Лекция №1.2 Проектная работа профессии голубого неба
Проектная работа профессии голубого неба Женщины-спортсменки 20 века
Женщины-спортсменки 20 века Нарушения мышления
Нарушения мышления Олефиновые углеводороды как сырье для органического синтеза. Реакции олефинов. Способы производства олефинов. Лекция 4
Олефиновые углеводороды как сырье для органического синтеза. Реакции олефинов. Способы производства олефинов. Лекция 4 Дорожное движение. Для 3-х летних малышей
Дорожное движение. Для 3-х летних малышей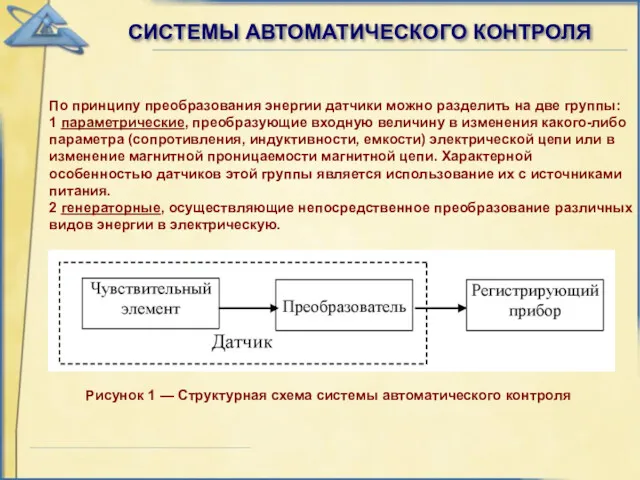 Системы автоматического контроля
Системы автоматического контроля Мероприятие ко Дню Победы
Мероприятие ко Дню Победы To say, to tell, to speak, to talk
To say, to tell, to speak, to talk интеллектуальная игра по географии Крестики-нолики
интеллектуальная игра по географии Крестики-нолики