Слайд 2

Железо не только основа всего мира,
самый главный металл окружающей нас
природы, оно – основа культуры и промышленности, оно – орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлым, настоящим и будущими судьбами человечества.
А. Е. Ферсман.
Слайд 3

Физминутка:
«Клоуны»
Брови свести и развести;
Глаза сильно прищурить и широко открыть;
Губы максимально растянуть
в улыбке, а затем поджать их;
Шею максимально вытянуть, а затем опустить её;
Плечи максимально свести и развести;
Руками обнять себя, погладить и пожелать себе успехов, улыбнуться.
Слайд 4

Охарактеризуйте Fe как химический элемент, составив предложения со словами и словосочетаниями:
Порядковый
номер, номер периода , группа, подгруппа
Порядковый № 26, 4 период , VIII В группа
Заряд ядра, распределение электронов по уровням
Заряд ядра +26, распределение é 2, 8, 14, 2
Электронная формула внешнего уровня
…4s2 3d6
Степени окисления
+2, + 3
Слайд 5
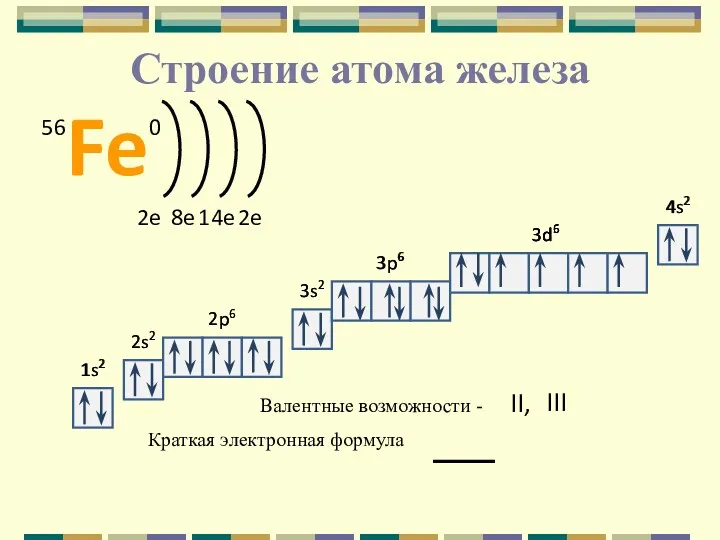
Строение атома железа
1s2
2s2
2p6
3s2
3p6
1s2
2s2
2p6
3s2
Краткая электронная формула
Валентные возможности -
II,
III
3d6
4s2
Fe
56
0
2e
8e
2e
14e
3p6
4s2
3d6
3d5
Слайд 6

Физические свойства железа
металлический блеск
теплопроводность
электропроводность
пластичность и ковкость
магнетизм
Слайд 7

физические свойства железа:
Серебристо-белый металл
Металлический блеск
Tемпература плавления +1539оС
Пластичный, ковкий
Проводит электрический
ток
Проводит тепло
Легко намагничивается и размагничивается
Слайд 8

Химические свойства железа
Взаимодействие железа с хлором:
2Fe + 3Cl2 = 2FeCl3
Слайд 9

Химические свойства железа
Взаимодействие железа с кислородом:
Fe + O2 =
Fe3O4
(FeO*Fe2O3)
3
2
Слайд 10

Химические свойства железа
2Fe + 3Cl2 → 2FeCl3
6Fe + 4O2
→ 2Fe3O4
Fe + 2HCl (разб) → FeCl2 + H2
Fe + CuSO4→ Cu + FeSO4
3Fe + 4H2O (пар) → Fe3O4 + 4H2
Слайд 11
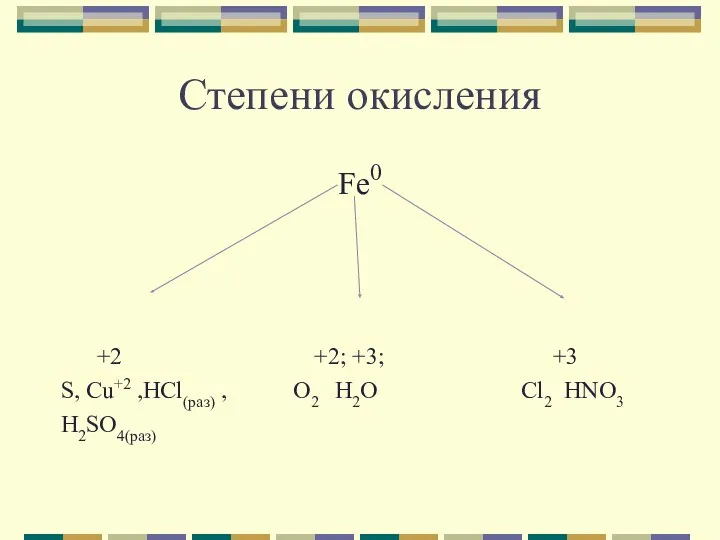
Степени окисления
Fe0
+2 +2; +3; +3
S, Cu+2 ,HCl(раз) , O2 H2O Cl2
HNO3
H2SO4(раз)
Слайд 12

ПРИМЕНЕНИЕ
Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют
для изготовления трансформаторов, электромоторов и мембран микрофонов. Основная масса железа на практике используется в виде сплавов – чугуна и стали.
Железо - самый употребляемый металл, на него приходится до 90 % мирового производства металлов.
Слайд 13

Нахождение в природе
В земной коре 5,1% железа, 4 место
после кислорода, кремния и алюминия.
По запасам железных руд Россия занимает 1 место в мире.
Слайд 14

Нахождение в природе
Метеоритное железо
Запишите не менее 4 -х формул
соединений железа, встречающихся в природе
Слайд 15

Природные соединения железа
Fe
FeS
Пирит
(железный или серный колчедан)
FeCO3
Сидерит
Fe2O3*3H2O Лимонит
(бурый железняк)
Fe3O4
(магнитный железняк)
Fe2O3
(красный железняк)
Слайд 16

«Попс-формула»
Сегодня я понял(а), что ………..
Главным на уроке для меня было ……….
Больше
всего мне запомнилось ……….
Слайд 17

Домашнее задание
§ 41, с. 188 -191 № 1 с. 190 -
всем
№ 5 с. 191 (задача), по желанию
















 Презентация Права ребенка (в 3-х частях).
Презентация Права ребенка (в 3-х частях). Свободное падение тел
Свободное падение тел С 20-ти летием
С 20-ти летием Спортивные мероприятия. Школьные соревнования
Спортивные мероприятия. Школьные соревнования Основы молекулярной физики и термодинамики
Основы молекулярной физики и термодинамики Печатные платы
Печатные платы Челябинский институт развития профессионального образования. Итоги деятельности студенческого научного общества
Челябинский институт развития профессионального образования. Итоги деятельности студенческого научного общества Храм - синтез искусств
Храм - синтез искусств Барокко в архитектуре
Барокко в архитектуре Под чистым снегом Рождества
Под чистым снегом Рождества Как помочь своему ребенку подготовиться к ЕГЭ.
Как помочь своему ребенку подготовиться к ЕГЭ. Приборы радиационной и химической разведки
Приборы радиационной и химической разведки Доказательная медицина. Формулярная система. Фармакоэпидемиология
Доказательная медицина. Формулярная система. Фармакоэпидемиология Физиология физической культуры и спорта
Физиология физической культуры и спорта Физиология системной и региональной гемодинамики
Физиология системной и региональной гемодинамики Проект Что такое снег и почему его нельзя есть
Проект Что такое снег и почему его нельзя есть Ежемесячная выплата в связи с рождением второго ребенка
Ежемесячная выплата в связи с рождением второго ребенка Нетрадиционные техники рисования как средство развития творческих способностей дошкольников
Нетрадиционные техники рисования как средство развития творческих способностей дошкольников Религиозная живопись
Религиозная живопись Оценка кредитоспособности
Оценка кредитоспособности Организация работы прививочного кабинета
Организация работы прививочного кабинета О бездомных животных
О бездомных животных Понятие стоимости и цены НИОКР. Затратные подходы к определению стоимости НИОКР
Понятие стоимости и цены НИОКР. Затратные подходы к определению стоимости НИОКР Жүйелік дерматомиозит
Жүйелік дерматомиозит Порядок неполной разборки и сборки автомата АК-74. Изготовка и производство стрельбы лёжа
Порядок неполной разборки и сборки автомата АК-74. Изготовка и производство стрельбы лёжа Организация обслуживания массового банкетного мероприятия в форме официального приёма. Праздничный ужин на 25 персон
Организация обслуживания массового банкетного мероприятия в форме официального приёма. Праздничный ужин на 25 персон выход за пределы. экологические проблемы.
выход за пределы. экологические проблемы. Озеро Байкал
Озеро Байкал