Содержание
- 2. Молекулярной физикой называется раздел физики, изучающий физические свойства веществ в различных агрегатных состояниях на основе их
- 3. Два метода исследования: 1. молекулярно-кинетический или статистический; 2. термодинамический.
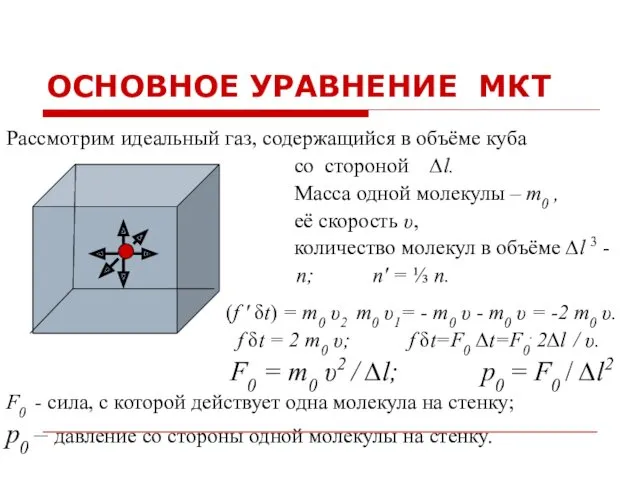
- 4. ОСНОВНОЕ УРАВНЕНИЕ МКТ Рассмотрим идеальный газ, содержащийся в объёме куба со стороной ∆l. Mасса одной молекулы
- 5. p=(⅓)n0m0 , где n0 - концентрация молекул, m0 - масса одной молекулы, - квадрат средней квадратичной
- 6. Основное уравнение МКТ можно преобразовать к виду: р= (⅔)n0 (m0 /2 ) или р = (⅔)n0
- 7. Уравнение состояния идеального газа (Уравнение Клапейрона-Менделеева) где - универсальная газовая постоянная; m – масса газа; μ-
- 8. Закон Дальтона Давление газовой смеси равно сумме парциальных давлений газов, составляющих смесь: р = р1 +
- 9. Распределение Максвелла Вид функции распределения молекул идеального газа по скоростям был установлен теоретически Максвеллом в 1860
- 10. Функция распределения Максвелла имеет вид: где N - общее число молекул; dN(υ)- число молекул скорости которых
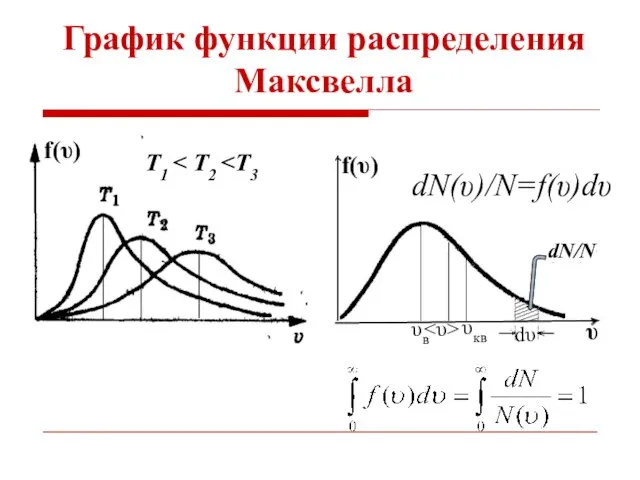
- 11. График функции распределения Максвелла f(υ) Т1 f(υ) υ dN/N dN(υ)/N=f(υ)dυ υв υкв
- 12. К графику функции распределения Максвелла Площадь, ограниченная кривой распределения и осью абсцисс, равна единице, так как
- 13. Наиболее вероятная скорость Функция f(v) начинаясь от нуля, достигает максимума при vВ (наиболее вероятной скорости)
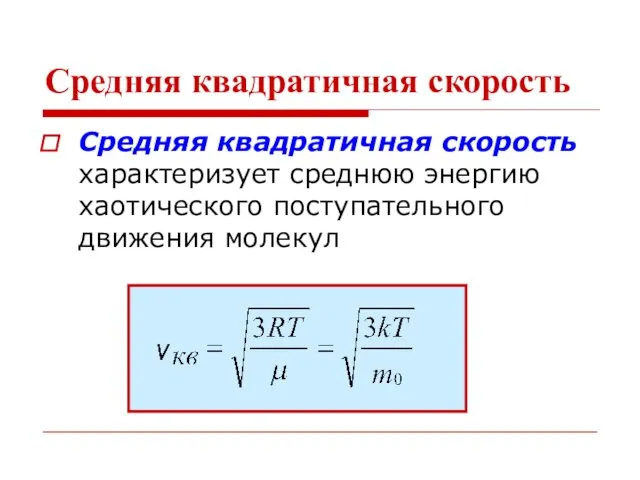
- 14. Средняя квадратичная скорость Средняя квадратичная скорость характеризует среднюю энергию хаотического поступательного движения молекул
- 15. Средняя арифметическая скорость Средняя арифметическая скорость
- 16. Барометрическая формула Барометрическая формула определяет закон изменения давления идеального газа в зависимости от высоты над уровнем
- 17. Закон Больцмана Подставляя р = nkT, р0 = n0kT в барометрическую формулу, получим распределение Больцмана (закон
- 18. Распределение Больцмана справедливо и для газа, находящегося в любом потенциальном поле. При этом величина m0gh заменяется
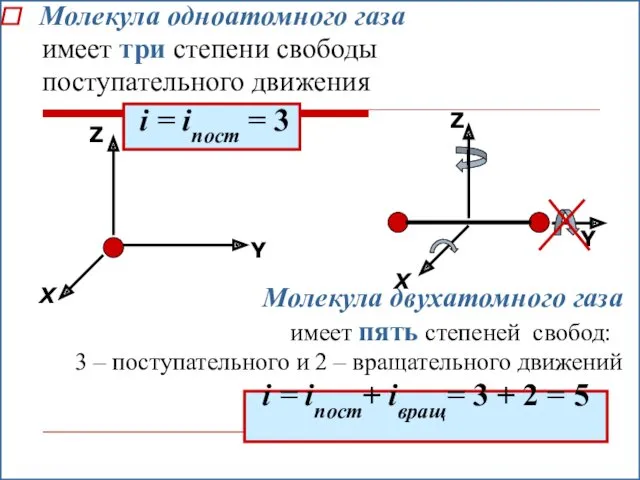
- 19. Понятие о степенях свободы Числом степеней свободы тела называется наименьшее число независимых координат, полностью определяющих положение
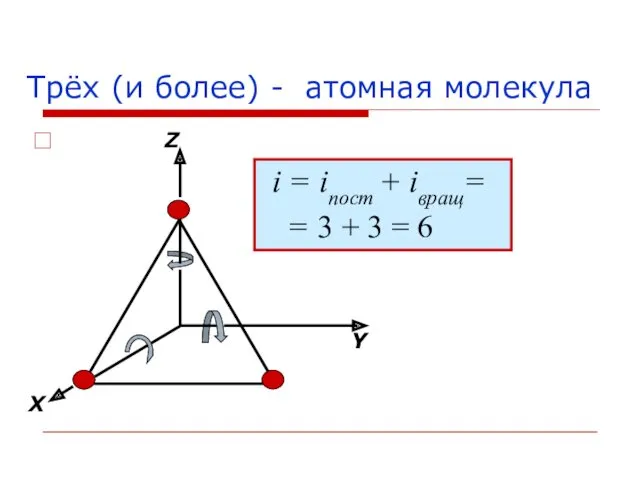
- 20. Молекула одноатомного газа имеет три степени свободы поступательного движения i = iпост = 3 Молекула двухатомного
- 21. i = iпост + iвращ= = 3 + 3 = 6 Трёх (и более) - атомная
- 22. Закон равнораспределения энергии по степеням свободы (закон Больцмана) На каждую степень свободы поступательного и вращательного движений
- 23. Энергия молекулы Для поступательного движения одноатомной молекулы: =3/2 (kT) =1/2 (kT), где - энергия, приходящаяся на
- 25. Скачать презентацию

















 Конвертопланы. Авиамоделирование
Конвертопланы. Авиамоделирование Бронхиальная астма
Бронхиальная астма Презентация Правила дорожного движения
Презентация Правила дорожного движения Портфолиосы
Портфолиосы Игра-презентация для детей дошкольного возраста Скажи по-другому (синонимы).
Игра-презентация для детей дошкольного возраста Скажи по-другому (синонимы). География машиностроительного комплекса России
География машиностроительного комплекса России Виды речевых и грамматических ошибок
Виды речевых и грамматических ошибок Химия 10 класс. Органическая химия. Природные источники углеводородов. Природный газ.
Химия 10 класс. Органическая химия. Природные источники углеводородов. Природный газ. Проектная деятельность школьника
Проектная деятельность школьника Экономика Германии
Экономика Германии Акушерские кровотечения
Акушерские кровотечения транспорт
транспорт Строение вещества
Строение вещества Инструменты и приспособления, применяемые при выполнении ручных работ
Инструменты и приспособления, применяемые при выполнении ручных работ Сероводород. Сульфиды. 9 класс
Сероводород. Сульфиды. 9 класс Молодежь выбирает будущее. Командная интеллектуальная игра
Молодежь выбирает будущее. Командная интеллектуальная игра Обучение и воспитание дошкольников с нарушениями слуха
Обучение и воспитание дошкольников с нарушениями слуха Коррекционный час в ГПД
Коррекционный час в ГПД Баланстың өтімділігін және төлем қабілеттілігін талдау
Баланстың өтімділігін және төлем қабілеттілігін талдау Международный день энергосбережения
Международный день энергосбережения Основные этапы производства ткани
Основные этапы производства ткани Traditions of America
Traditions of America Документальное оформление и учёт денежных средств в кассе и денежных документов
Документальное оформление и учёт денежных средств в кассе и денежных документов Презентация к открытому занятию ПМ 01 Диагностическая деятельность МДК Пропедевтика клинических дисциплин Тема: Питание и гигиена во второй половине беременности. Гимнастика беременной женщины
Презентация к открытому занятию ПМ 01 Диагностическая деятельность МДК Пропедевтика клинических дисциплин Тема: Питание и гигиена во второй половине беременности. Гимнастика беременной женщины Христианская апологетика и история
Христианская апологетика и история бибурок 9 класс
бибурок 9 класс Призентация ПАСХА2015
Призентация ПАСХА2015 Дидактическая игра 4-й лишний. Выделение первого звука в слове.Часть 1,2
Дидактическая игра 4-й лишний. Выделение первого звука в слове.Часть 1,2