Содержание
- 2. Сероводород
- 3. Сероводород в природе Входит в состав вулканических газов. Образуется при гниении белков. Встречается в минеральных источниках
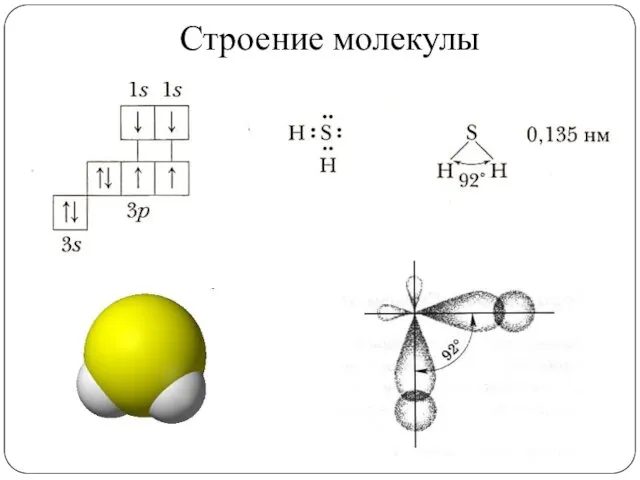
- 4. Строение молекулы
- 5. Газ, без цвета, с запахом тухлых яиц, ядовит (в больших концентрациях без запаха), тяжелее воздуха, растворим
- 6. Очень ядовит. Даже один вздох чистого сероводорода ведет к потере сознания из-за паралича дыхательного центра. Его
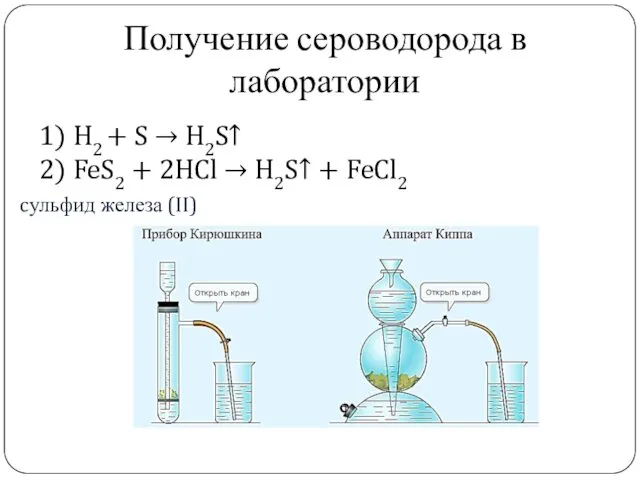
- 7. cульфид железа (II) Получение сероводорода в лаборатории 1) H2 + S → H2S↑ 2) FeS2 +
- 8. Химические свойства сероводорода
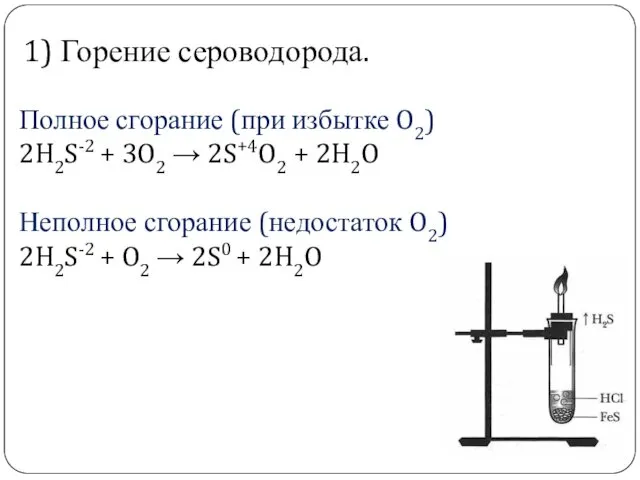
- 9. 1) Горение сероводорода. Полное сгорание (при избытке O2) 2H2S-2 + 3O2 → 2S+4O2 + 2H2O Неполное
- 10. . H2S-2 + Br2 → S0 + 2HBr H2S-2 + 2FeCl3 → 2FeCl2 + S0 +
- 11. . 3) Взаимодействие с водой. Раствор H2S в воде – слабая двухосновная кислота (сероводородная кислота) Диссоциация
- 12. . Взаимодействует с основаниями: H2S + 2NaOH изб. → Na2S + 2H2O H2S изб. + NaOH
- 13. . Н2S + Pb(NO3)2 → PbS↓ + 2HNO3 Pb2+ + S2- → PbS↓ черный черный 5)
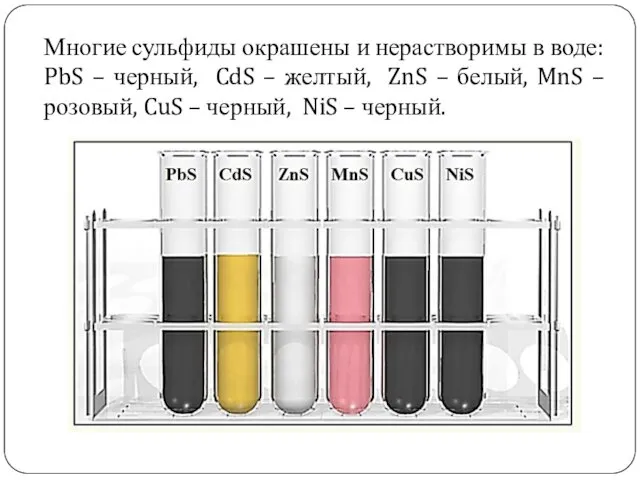
- 14. . Многие сульфиды окрашены и нерастворимы в воде: PbS – черный, CdS – желтый, ZnS –
- 15. Применение сероводорода Сероводород из-за своей токсичности находит ограниченное применение. В медицине - в составе природных и
- 16. ЭОР: Закрепление материала Опыт. Получение сероводорода и изучение его свойств. Модуль. Сероводород. Сульфиды. Выполните задания: 1.
- 17. Домашнее задание: §18 упр.6, упр. 9 по желанию (творческое задание: найдите ответ, почему картины старых мастеров
- 19. Скачать презентацию











 Теория алгоритмов
Теория алгоритмов Предприятия и их объединения. Урок технологии 11 класс
Предприятия и их объединения. Урок технологии 11 класс Поздравительная открытка в технике Изонить.
Поздравительная открытка в технике Изонить. Нестандартные периферийные устройства ПК
Нестандартные периферийные устройства ПК Торгово-развлекательный комплекс Берёзки. Планировка
Торгово-развлекательный комплекс Берёзки. Планировка Безнең эшләребез.
Безнең эшләребез. Средневековый Херсонес. Тема 6
Средневековый Херсонес. Тема 6 Строительство школы в г. Видное
Строительство школы в г. Видное Игры звуками - это музыкальная импровизация
Игры звуками - это музыкальная импровизация От февраля к октябрю 17
От февраля к октябрю 17 Стартап. Киберспорт
Стартап. Киберспорт Тематические коррекционно-развивающие занятия (индивидуальная работа)
Тематические коррекционно-развивающие занятия (индивидуальная работа) Развитие малых форм хозяйствования в Республике Мордовия
Развитие малых форм хозяйствования в Республике Мордовия Психология развития: концепция Э. Эриксона психостадиального развития личности
Психология развития: концепция Э. Эриксона психостадиального развития личности Экологические правила.
Экологические правила. Презентация к классному часу в 3 классе по теме Моя малая Родина - Шаховская
Презентация к классному часу в 3 классе по теме Моя малая Родина - Шаховская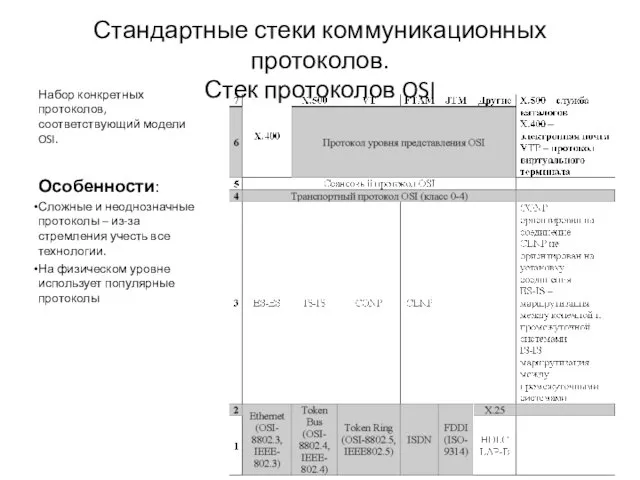 Стандартные стеки коммуникационных протоколов. Стек протоколов OSI
Стандартные стеки коммуникационных протоколов. Стек протоколов OSI Значение сюжетно-ролевой игры в развитии дошкольника
Значение сюжетно-ролевой игры в развитии дошкольника Тест Кеттелла
Тест Кеттелла Урок-игра по России
Урок-игра по России Морфологические и молекулярно-генетические параллели в профилактике и диагностике новообразований
Морфологические и молекулярно-генетические параллели в профилактике и диагностике новообразований День экологических знаний
День экологических знаний ИСТОРИЯ СОЗДАНИЯ LEGO
ИСТОРИЯ СОЗДАНИЯ LEGO Грэм Пол - американдық кәсіпкер, эссеист, бағдарламашы, танымал жақтаушы
Грэм Пол - американдық кәсіпкер, эссеист, бағдарламашы, танымал жақтаушы ветер
ветер Stone Age Home
Stone Age Home Материалы по дисциплине Нервные болезни
Материалы по дисциплине Нервные болезни Разработка автоматической противопожарной защиты ООО МАК-Иваново г. Иваново
Разработка автоматической противопожарной защиты ООО МАК-Иваново г. Иваново