Содержание
- 2. Содержание Виды оксидов азота. Оксид азота( Оксид азота(I) Оксид азота(I). Оксид азота( Оксид азота(II) Оксид азота(II).
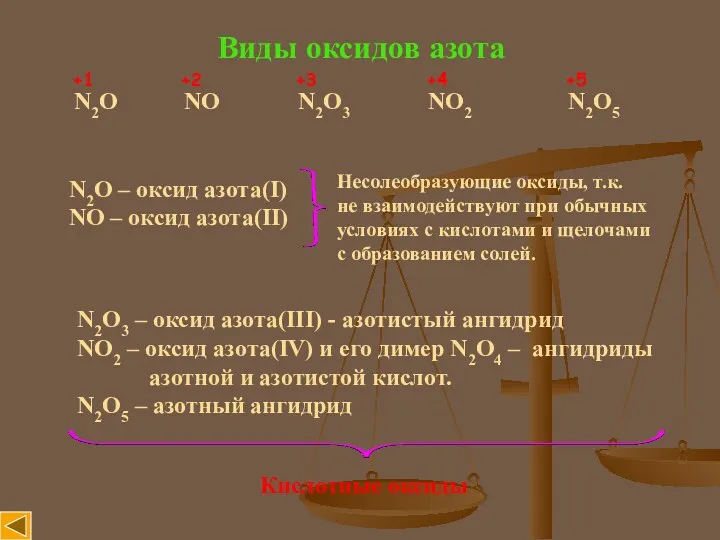
- 3. Виды оксидов азота N2O NO N2O3 NO2 N2O5 +1 +2 +3 +4 +5 N2O – оксид
- 4. Оксид азота(I) - N2O (“веселящий газ”) Физические свойства. Бесцветный газ с тошнотворным cладковатым запахом, обладает анестезирующим
- 5. Оксид азота(II) - NO Физические свойства. Бесцветный газ, при низких температурах - голубая жидкость. В твердом
- 6. Химические свойства. Очень реакционноспособное вещество. Может проявлять и окислительные и восстановительные свойства. 1. При обычной температуре
- 7. Оксид азота(III) - азотистый ангидрид Физические свойства. Это синяя жидкость при обычных условиях. В твердом состоянии
- 8. Оксид азота(IV) - NO2 и его димер N2O4 Физические свойства. Это красно-бурый газ с резким запахом.
- 9. Химические свойства. Взаимодействие с водой: 2NO2 + H2O(хол) = HNO3 + HNO2 3NO2 + H2O(гор) =
- 10. Оксид азота(V) - азотный ангидрид Строение. N O N Физические свойства. Белое кристаллическое вещество, летучее, неустойчивое.
- 11. Химические свойства. Оксид азота(V) - кислотный оксид. 1. При растворении в воде образует азотную кислоту: N2O5
- 13. Скачать презентацию









 Психологические особенности воспитания девочек в пубертатный период
Психологические особенности воспитания девочек в пубертатный период Мультимедийная презентация к игре Галактический поединок
Мультимедийная презентация к игре Галактический поединок творческий проект по благоустройству участка Божьи коровки.
творческий проект по благоустройству участка Божьи коровки. Современные требования к реализации дополнительных общеобразовательных программ
Современные требования к реализации дополнительных общеобразовательных программ Vyyavlenie_potrebnostey
Vyyavlenie_potrebnostey Сооружение опор выше обреза фундамента. Тема № 3
Сооружение опор выше обреза фундамента. Тема № 3 Работы учащихся 9 классов ГБОУ СОШ 599 (презентации к уроку)
Работы учащихся 9 классов ГБОУ СОШ 599 (презентации к уроку) Геометрія навколо нас
Геометрія навколо нас презентация для самообразования учителей о Кембриджской Программе внедрения семи модулей, как Новых подходах в воспитании и обучении детей.
презентация для самообразования учителей о Кембриджской Программе внедрения семи модулей, как Новых подходах в воспитании и обучении детей. Жизнь на Земле
Жизнь на Земле Теоретические основы мониторинга и внутреннего контроля в образовательном учреждении
Теоретические основы мониторинга и внутреннего контроля в образовательном учреждении Этапы планирования деятельности организации и управления по изготовлению рекламного продукта туристической фирмы TEZ TOUR
Этапы планирования деятельности организации и управления по изготовлению рекламного продукта туристической фирмы TEZ TOUR ИКТ в работе учителя классов КРО
ИКТ в работе учителя классов КРО Оффшорная компания на Кипре
Оффшорная компания на Кипре Таблица умножения на 2
Таблица умножения на 2 Путешествие по сказке Гуси - Лебеди. Мультимедийная игра для детей среднего дошкольного возраста
Путешествие по сказке Гуси - Лебеди. Мультимедийная игра для детей среднего дошкольного возраста Значение эмоций для формирования положительного взаимодействия ребенка с окружающим миром
Значение эмоций для формирования положительного взаимодействия ребенка с окружающим миром Сочинение-рассуждение на лингвистическую тему. Задание 15.1 ОГЭ-9
Сочинение-рассуждение на лингвистическую тему. Задание 15.1 ОГЭ-9 Берегите первоцветы!
Берегите первоцветы! Зардап шеккендерге психологиялық көмек көрсету дағдыларын қалыптастыру
Зардап шеккендерге психологиялық көмек көрсету дағдыларын қалыптастыру презентация к уроку по теме Кислород
презентация к уроку по теме Кислород Медицинская гельминтология. Тип круглые черви. Лекция №2
Медицинская гельминтология. Тип круглые черви. Лекция №2 Что такое текст? 5 класс
Что такое текст? 5 класс Аппликация осьминожка паучок 1 класс
Аппликация осьминожка паучок 1 класс Новогодний конкурс 2021-2022 гг
Новогодний конкурс 2021-2022 гг Мастер-класс Игольница
Мастер-класс Игольница презентация Подготовка ребёнка к школе
презентация Подготовка ребёнка к школе До витоку Збруча
До витоку Збруча