Содержание
- 2. Углеводы - органические соединения, содержащие в молекуле одновременно альдегидную или кето- группу и несколько спиртовых групп.
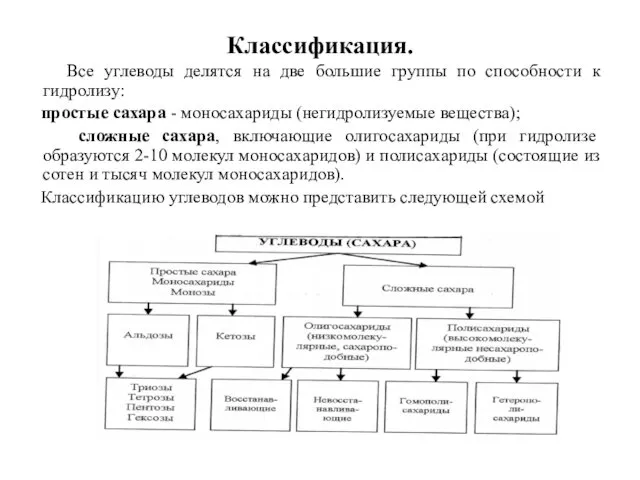
- 3. Классификация. Все углеводы делятся на две большие группы по способности к гидролизу: простые сахара - моносахариды
- 4. Моносахариды В зависимости от числа углеродных атомов (3-7) моносахариды относятся к триозам, тетрозам, пентозам и гексозам.
- 5. Линейные формы альдогексоз. Важнейшие представители из гексоз являются глюкоза, фруктоза, галактоза и манноза: даны в виде
- 6. Принадлежность любой монозы к D- или L - ряду определяется по конфигурации ее последнего асимметрического атома
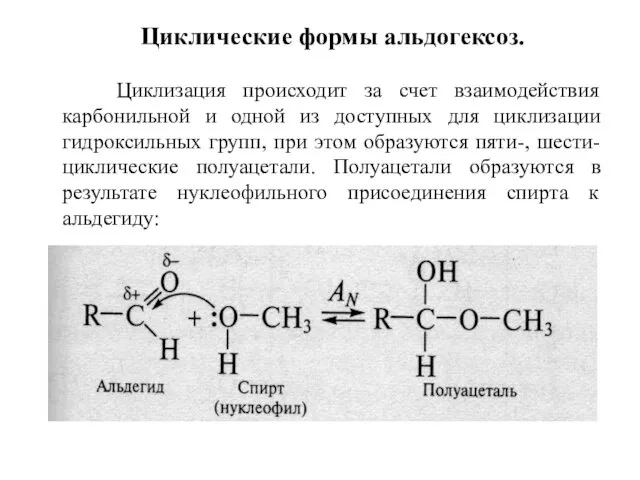
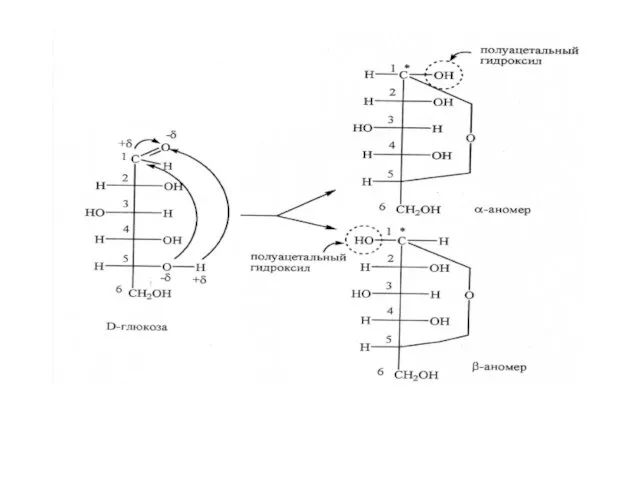
- 7. Циклические формы альдогексоз. Циклизация происходит за счет взаимодействия карбонильной и одной из доступных для циклизации гидроксильных
- 9. Моносахариды образуют циклическую полуацеталь. Образование циклической формы сопровождается появлением нового гидроксила, получившего название гликозидного. Так как
- 10. Цикло-цепная таутомерия моноз Все монозы в кристаллическом состоянии имеют циклическое строение (α или β). При растворении
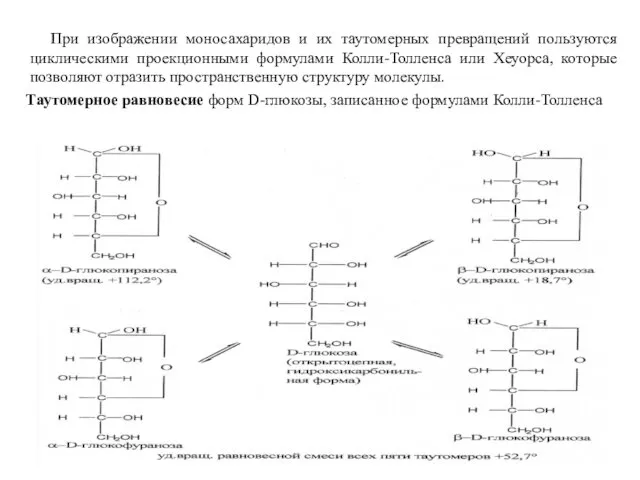
- 11. При изображении моносахаридов и их таутомерных превращений пользуются циклическими проекционными формулами Колли-Толленса или Хеуорса, которые позволяют
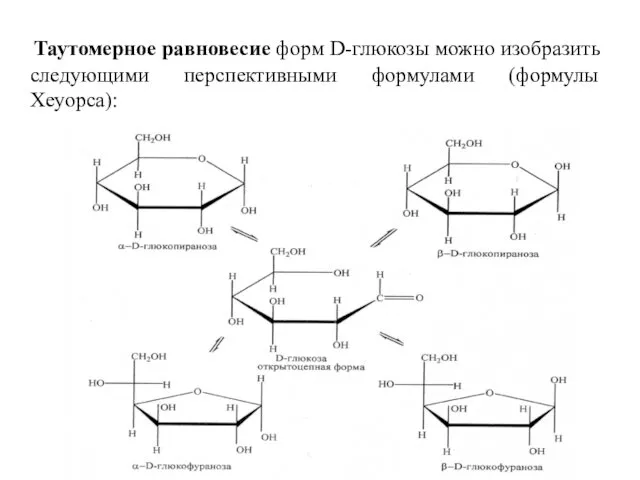
- 12. Таутомерное равновесие форм D-глюкозы можно изобразить следующими перспективными формулами (формулы Хеуорса):
- 13. Химические свойства моносахаридов Химические свойства моносахаридов определяются природой их функциональных групп и строением молекул. Моносахариды находятся
- 14. Реакции по альдегидной группе Характерные реакции окисления моносахаридов протекают легко, процесс и продукты реакции зависят от
- 15. Реакция Толленса или р-я «серебряного зеркала»
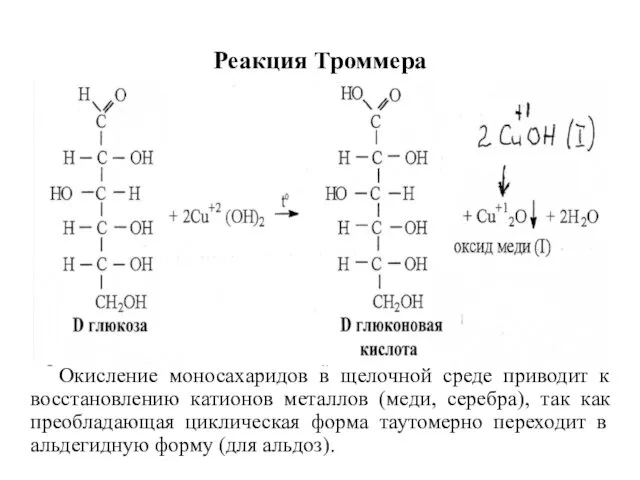
- 16. Реакция Троммера Окисление моносахаридов в щелочной среде приводит к восстановлению катионов металлов (меди, серебра), так как
- 17. Реакции по гидроксильным группам Моносахариды по гидроксильным группам могут образовывать простые эфира, сложные эфиры или сахараты
- 18. Реакции алкилирования Реакции моноалкилирования. Одна из важнейших реакций моносахаридов - взаимодействие с гидроксилсодержащими соединениями (спиртами, фенолами
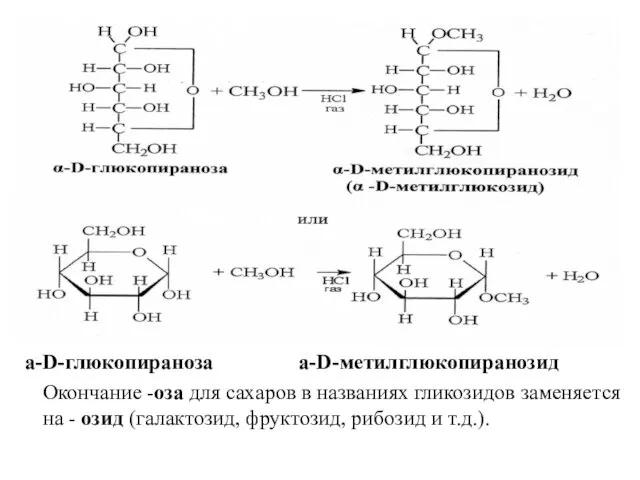
- 19. а-D-глюкопираноза а-D-метилглюкопиранозид Окончание -оза для cахаров в названиях гликозидов заменяется на - озид (галактозид, фруктозид, рибозид
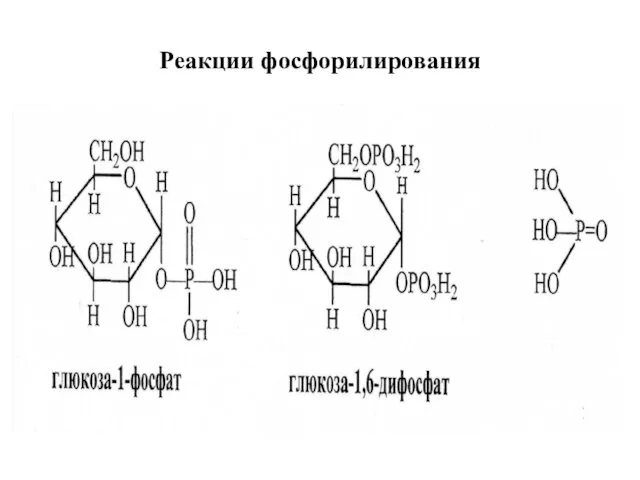
- 20. Реакции фосфорилирования
- 21. Дисахариды Наиболее распространенными природными олигосахаридами являются дисахариды, состоящие из двух моносахаридных звеньев одинаковой или разной природы,
- 22. В дисахаридах с дигликозидной связью отсутствует свободный полуацетальный гидроксил и невозможна циклоцепная таутомерия, т.е. невозможен переход
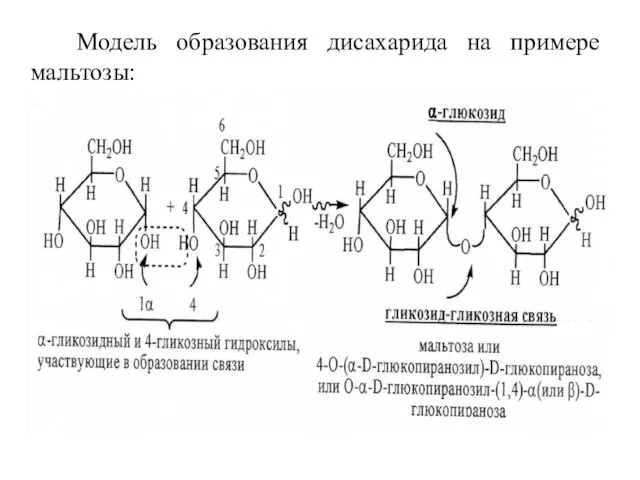
- 23. Модель образования дисахарида на примере мальтозы:
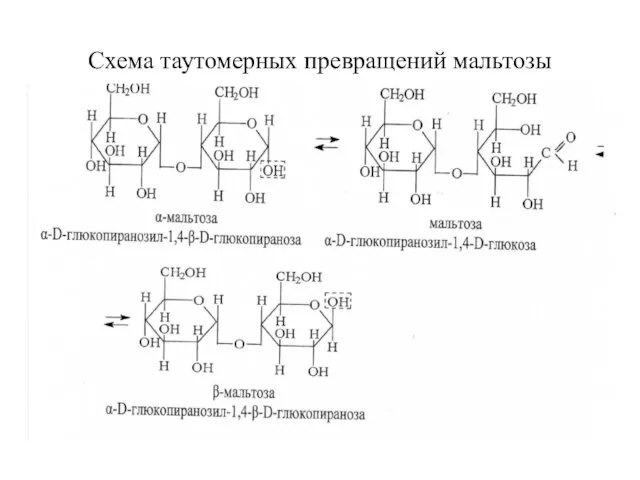
- 24. Восстанавливающие дисахариды. Мальтоза (солодовый сахар). В мальтозе остатки двух молекул а-D-глюкопиранозы связаны -1,4-а-гликозидной связью и аномерный
- 25. Схема таутомерных превращений мальтозы
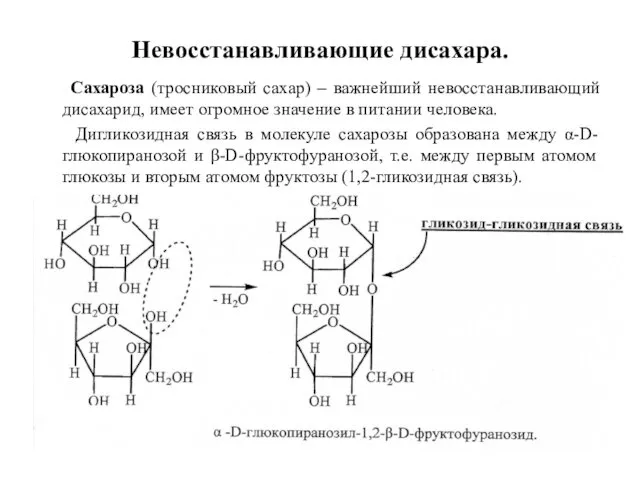
- 26. Невосстанавливающие дисахара. Сахароза (тросниковый сахар) – важнейший невосстанавливающий дисахарид, имеет огромное значение в питании человека. Дигликозидная
- 27. Полисахариды Высокомолекулярные углеводы являются продуктами поликонденсации моносахаридов, соединенные кислородными мостиками в длинные неразветвленные или разветвленные цепи.
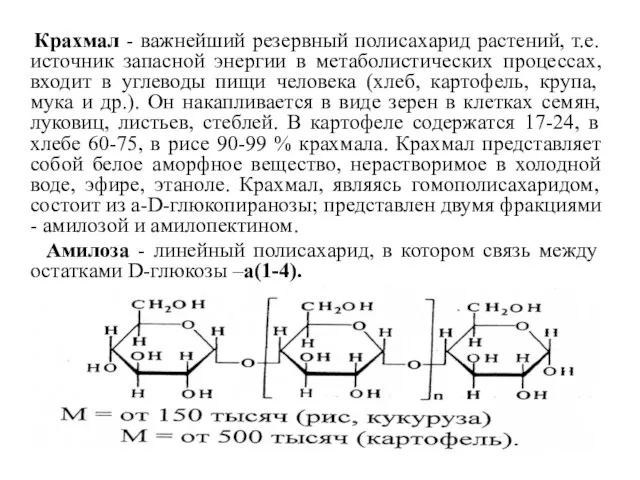
- 28. Крахмал - важнейший резервный полисахарид растений, т.е. источник запасной энергии в метаболистических процессах, входит в углеводы
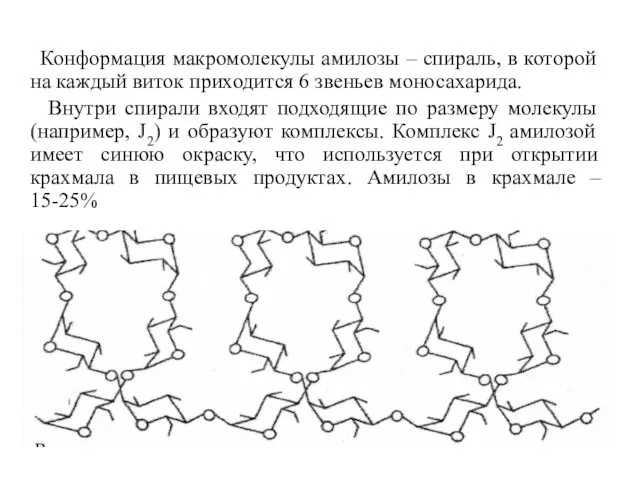
- 29. Конформация макромолекулы амилозы – спираль, в которой на каждый виток приходится 6 звеньев моносахарида. Внутри спирали
- 31. Скачать презентацию















 Правила варки заправочных супов
Правила варки заправочных супов Готовые шаблоны для презентаций.
Готовые шаблоны для презентаций. Влияние факторов окружающей среды на физическую работоспособность
Влияние факторов окружающей среды на физическую работоспособность ВОЗ
ВОЗ Создание Gif анимации в Gimp
Создание Gif анимации в Gimp Зачем нужна дисциплина
Зачем нужна дисциплина Презентация. Воспитание любви к природе через дидактические игры у детей младшего дошкольного возраста
Презентация. Воспитание любви к природе через дидактические игры у детей младшего дошкольного возраста Механизм электронных аукционов
Механизм электронных аукционов Профилактическая работа по оптимизации психологического здоровья педагогов
Профилактическая работа по оптимизации психологического здоровья педагогов Алкоголизм. Токсикомания
Алкоголизм. Токсикомания Многообразие пресмыкающихся
Многообразие пресмыкающихся Льюис Кэрролл, сказка Алиса в Стране чудес
Льюис Кэрролл, сказка Алиса в Стране чудес Средства и методы оказания первой помощи. (Тема 2)
Средства и методы оказания первой помощи. (Тема 2) Гепатиты и циррозы
Гепатиты и циррозы Работа над звуко-слоговой структурой слова у детей с нарушениями интеллекта старшего дошкольного возраста
Работа над звуко-слоговой структурой слова у детей с нарушениями интеллекта старшего дошкольного возраста  Миссия и ценности Сбербанка что они значат для меня
Миссия и ценности Сбербанка что они значат для меня Напиши письмо животному
Напиши письмо животному Разные типы занятий и их роль в экологическом воспитании детей
Разные типы занятий и их роль в экологическом воспитании детей Цифровая система передачи данных
Цифровая система передачи данных Неделя Математики. Конкурс Считай,смекай,отгадывай. 5класс
Неделя Математики. Конкурс Считай,смекай,отгадывай. 5класс Литературные места Крыма
Литературные места Крыма Урок этики :Добро,добрые дела
Урок этики :Добро,добрые дела Носовые кровотечения при лейкозах
Носовые кровотечения при лейкозах Деловые переговоры
Деловые переговоры Одноковшовый экскаватор
Одноковшовый экскаватор Заболевания эндокринной системы
Заболевания эндокринной системы Несущая система
Несущая система Смешанные числа. 5 класс
Смешанные числа. 5 класс