Содержание
- 2. План занятия Основные понятия химии Состав веществ. Изменение веществ Основные законы химии. Обозначения, названия и единицы
- 3. Основные задачи: · образовательные : знать основные положения атомно-молекулярного учения, понятия: атом, молекула, химический элемент, простые
- 4. Цели: Систематизировать и обобщить знания об основных понятиях и законах химии. Применение знаний на практике: при
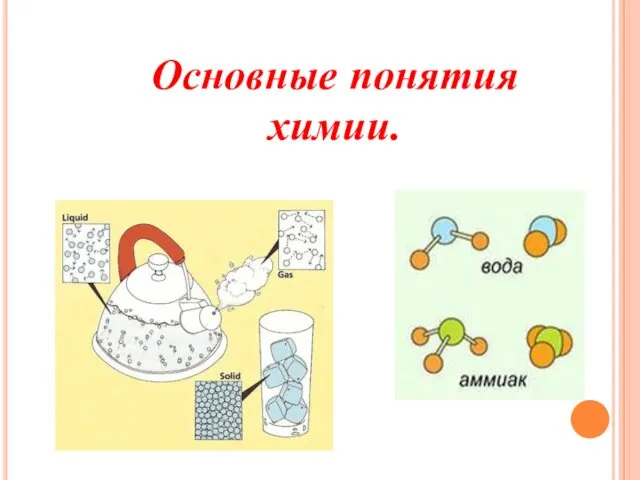
- 5. Основные понятия химии.
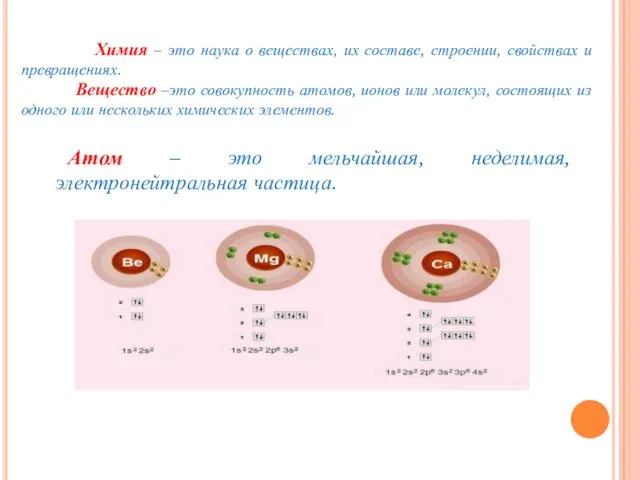
- 6. Атом – это мельчайшая, неделимая, электронейтральная частица. Химия – это наука о веществах, их составе, строении,
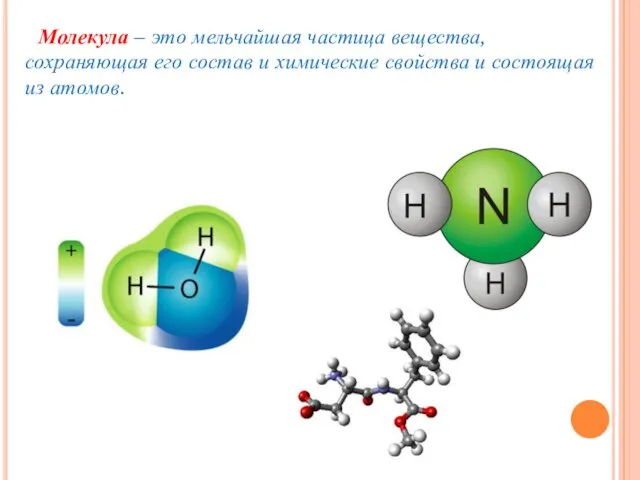
- 7. Молекула – это мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- 8. Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Например: сера S, углерод C, кальций
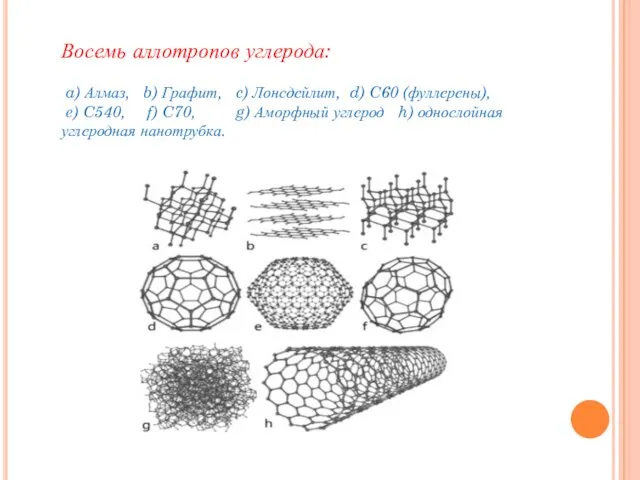
- 10. Восемь аллотропов углерода: a) Алмаз, b) Графит, c) Лонсдейлит, d) C60 (фуллерены), e) C540, f) C70,
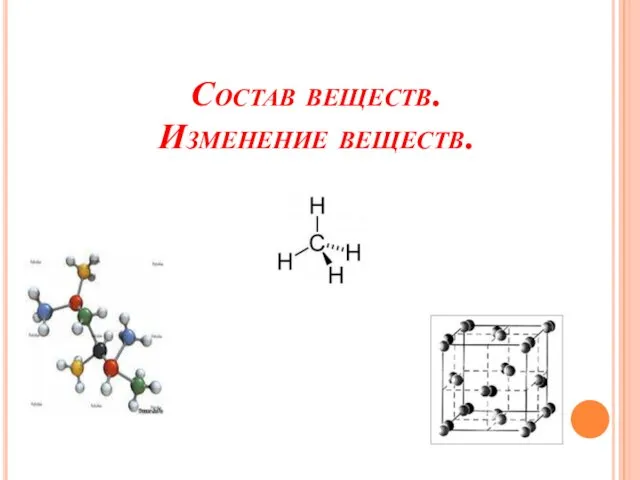
- 11. Состав веществ. Изменение веществ.
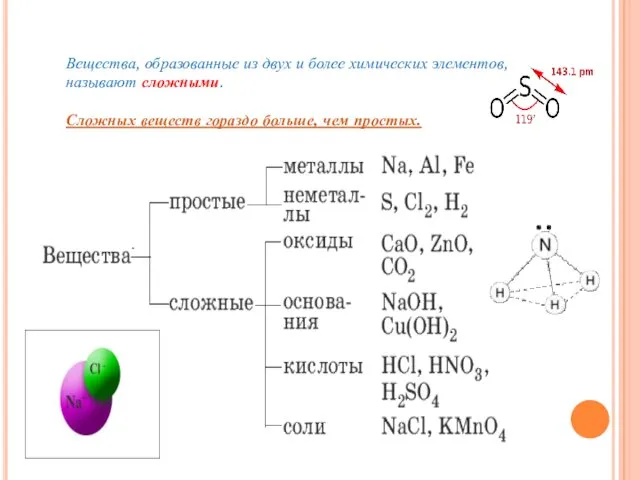
- 12. Простые вещества – это вещества, образованные одним химическим элементом.
- 13. Вещества, образованные из двух и более химических элементов, называют сложными. Сложных веществ гораздо больше, чем простых.
- 14. Различают в качественный и количественный состав веществ. Качественный состав – это совокупность химических элементов и (или)
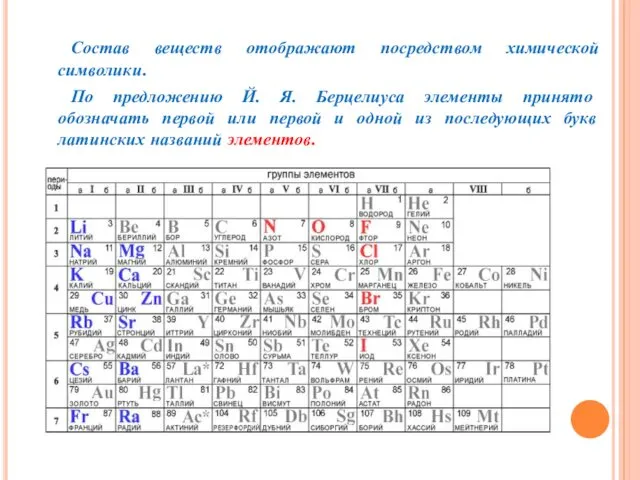
- 15. Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или
- 16. Химический знак (символ) – несет значительную информацию. Он обозначает название элемента, один его атом, один моль
- 17. Химическая формула – это способ отображения химического состава вещества. Она обозначает название вещества, одну молекулу его,
- 18. Широко используются несколько видов химических формул: Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых
- 19. Относительная атомная масса ( ) химического элемента – это величина, показывающая отношение средней массы атома природной
- 20. Относительная атомная масса – одна из основных характеристик химического элемента. Относительная молекулярная масса ( ) равна
- 21. Количество вещества (n или v) характеризуют числом атомов, молекул или других формульных единиц данного вещества. В
- 22. Постоянная Авогадро ( ) – число атомов или молекул (или других формульных единиц), содержащихся в одном
- 23. Основные законы химии
- 24. Закон сохранения массы. Был открыт М. В. Ломоносовым (1748г.) и сформулирован А. Лавуазье (1789г.): Масса веществ,
- 25. Закон постоянства состава вещества. Сформулирован Ж.-Л. Прустом в 1799 г.: все индивидуальные вещества имеют постоянный качественный
- 26. Современная формулировка закона постоянства состава вещества таков: Состав соединений молекулярной структуры является постоянным независимо от способа
- 27. Из закона Авогадро вытекают 2 следствия: Один моль любого газа при одинаковых условиях занимает один и
- 28. Задания для закрепления: Тест по теме «Предмет химии. Вещества». 1.Что изучает наука химия? Это наука о
- 29. 6. Вещество: 1. Медная проволока 2.Медная монета 3. Медная пластина 4.Медь 7. Простое вещество: 1.Водород 2.Углекислый
- 31. Скачать презентацию





















 Болезнь Альцгеймера
Болезнь Альцгеймера Внеклассное мероприятие (презентация) для учащихся 6 класса Командная географическая игра Богатства недр Земли
Внеклассное мероприятие (презентация) для учащихся 6 класса Командная географическая игра Богатства недр Земли классный уголок
классный уголок Все работы хороши...
Все работы хороши... Классификация машин для земляных работ
Классификация машин для земляных работ Программа Adobe Photoshop. Базовые инструменты. Типовые задачи
Программа Adobe Photoshop. Базовые инструменты. Типовые задачи Преимущества и недостатки 1С: Бухгалтерии по сравнению с другими автоматизированными программами бухгалтерского учета
Преимущества и недостатки 1С: Бухгалтерии по сравнению с другими автоматизированными программами бухгалтерского учета Блокчейн технологиясы
Блокчейн технологиясы ВПР биология 6 класс 2018 год. №3. Работа с текстом. Клеточное строение. Многообразие организмов
ВПР биология 6 класс 2018 год. №3. Работа с текстом. Клеточное строение. Многообразие организмов Хозяйство Западной Сибири
Хозяйство Западной Сибири Современный урок. Формирование УУД на уроке. Продуктивные задания. Организация рефлексивной деятельности
Современный урок. Формирование УУД на уроке. Продуктивные задания. Организация рефлексивной деятельности Конопля. Коноплеводство в России
Конопля. Коноплеводство в России Астраханский Кремль
Астраханский Кремль ФГОС нового поколения
ФГОС нового поколения КВН. Информатика
КВН. Информатика С Новым годом. Игра
С Новым годом. Игра Тромбоцитопеническая пурпура у детей
Тромбоцитопеническая пурпура у детей Передача цифровых сигналов в РРЛ и ССП. Технические характеристики РРС Р-169
Передача цифровых сигналов в РРЛ и ССП. Технические характеристики РРС Р-169 Классный час Сыны Отечества. Исаков Александр Варфоломеевич
Классный час Сыны Отечества. Исаков Александр Варфоломеевич Национальная стратегия действий в интересах детей на 2012 – 2017 годы
Национальная стратегия действий в интересах детей на 2012 – 2017 годы Аналоговые усилители. Классификация. Основные характеристики и параметры усилителей
Аналоговые усилители. Классификация. Основные характеристики и параметры усилителей Кодирование информации. Текст. Изображение. Звук
Кодирование информации. Текст. Изображение. Звук Театральная студия в начальной школе.
Театральная студия в начальной школе. Антон Павлович Чехов
Антон Павлович Чехов Воздействие сигнала и шума на ЧД (продолжение). Занятие №11
Воздействие сигнала и шума на ЧД (продолжение). Занятие №11 Именные стипендии губернатора области
Именные стипендии губернатора области Маркетинговые возможности спортивных сооружений
Маркетинговые возможности спортивных сооружений Основы маркетинга
Основы маркетинга