Содержание
- 2. В основу своей классификации химических элементов Д.И. Менделеев положил два их основных и постоянных признака: величину
- 3. При этом он обнаружил, что свойства элементов в некоторых пределах изменяются линейно (монотонно усиливаются или ослабевают),
- 4. На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной
- 5. Если написать ряды один под другим так, чтобы под литием находился натрий, а под неоном –
- 6. Периодический закон Д.И. Менделеева Современная трактовка Периодического закона: Свойства химических элементов и образуемых ими соединений находятся
- 7. Периоды Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и
- 8. МЕТАЛЛОИДЫ По своим химическим свойствам полуметаллы являются неметаллами, но по типу проводимости относятся к проводникам.
- 9. Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается
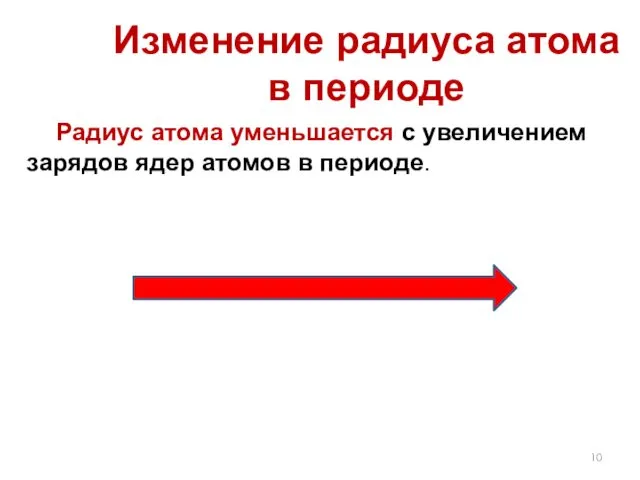
- 10. Радиус атома уменьшается с увеличением зарядов ядер атомов в периоде. Изменение радиуса атома в периоде
- 11. В одной группе с увеличением номера периода атомные радиусы возрастают. Изменение радиуса атома в периоде
- 12. Электроотрицательность - это способность атома притягивать электронную плотность. Электроотрицательность в периоде увеличивается с возрастанием заряда ядра
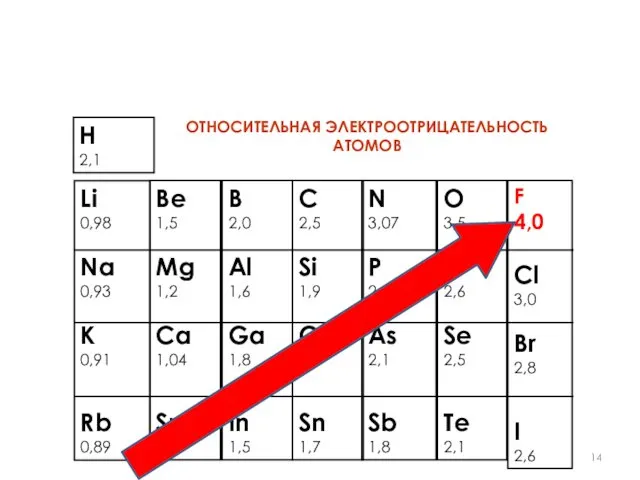
- 13. Электроотрицательность в группе увеличивается с уменьшением числа электронных слоев атома (снизу вверх). Самым электроотрицательным элементом является
- 14. Li 0,98 Na 0,93 К 0,91 Rb 0,89 Be 1,5 Mg 1,2 Ca 1,04 Sr 0,99
- 15. Восстановительные свойства атомов - способность терять электроны при образовании химической связи. Окислительные свойства атомов -способность принимать
- 16. В главных подгруппах снизу вверх, в периодах – слева направо окислительные свойства простых веществ элементов возрастают,
- 18. Скачать презентацию













 Нефтегазовая промышленность РФ: добыча и переработка топлива с использованием современных технологий
Нефтегазовая промышленность РФ: добыча и переработка топлива с использованием современных технологий Проект урока химии в 10 классе Физические и химические свойства алканов
Проект урока химии в 10 классе Физические и химические свойства алканов Вешалка
Вешалка Презентация к Всероссийскому уроку мужества
Презентация к Всероссийскому уроку мужества Computers in our life. Компьютеры в нашей жизни
Computers in our life. Компьютеры в нашей жизни Морфологические изменения твердых тканей зуба на различных стадиях кариозного процесса
Морфологические изменения твердых тканей зуба на различных стадиях кариозного процесса Нетрадиционные методы в логопедии.
Нетрадиционные методы в логопедии. 8 сентября - международный день грамотности
8 сентября - международный день грамотности Архитектура. Семь чудес света
Архитектура. Семь чудес света Реклама в СМИ
Реклама в СМИ Путешествие в страну первых блюд.
Путешествие в страну первых блюд. Методика развития связной речи у дошкольников
Методика развития связной речи у дошкольников Методическая копилка
Методическая копилка Название проекта. Дополнительная информация
Название проекта. Дополнительная информация Анализ работы отделения медицинской реабилитации 29-й городской поликлиники за 1 квартал 2015 года
Анализ работы отделения медицинской реабилитации 29-й городской поликлиники за 1 квартал 2015 года Логопедическое занятие Дифференциация звуков с-з в слогах и словах
Логопедическое занятие Дифференциация звуков с-з в слогах и словах Лекция № 10. Элементы релятивистской механики
Лекция № 10. Элементы релятивистской механики Щ.Анатол. Прабабушка
Щ.Анатол. Прабабушка Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Презентация к проекту В гостях у книжки
Презентация к проекту В гостях у книжки Жилые здания. Основы проектирования жилых зданий
Жилые здания. Основы проектирования жилых зданий Благоустройство лесопарков
Благоустройство лесопарков Кислород
Кислород Вены туловища
Вены туловища Лучшие книги о детях и для детей
Лучшие книги о детях и для детей Почему идет дождь?
Почему идет дождь? Моделирование прямой юбки. Способы моделирования
Моделирование прямой юбки. Способы моделирования Внеурочная деятельность. Нормативно-правовая база внеурочной деятельности
Внеурочная деятельность. Нормативно-правовая база внеурочной деятельности