Содержание
- 2. Вспомните, какие вещества мы называем углеводородами? УГЛЕВОДОРОДЫ – это органические соединения, состоящие из двух химических элементов
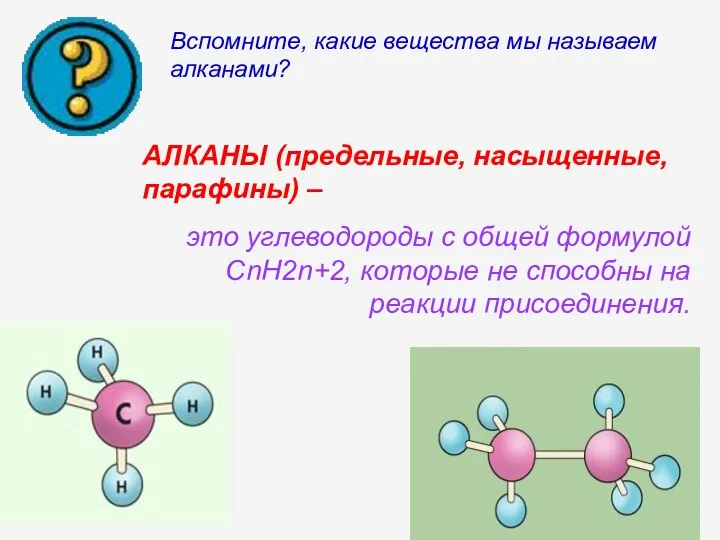
- 3. Вспомните, какие вещества мы называем алканами? АЛКАНЫ (предельные, насыщенные, парафины) – это углеводороды с общей формулой
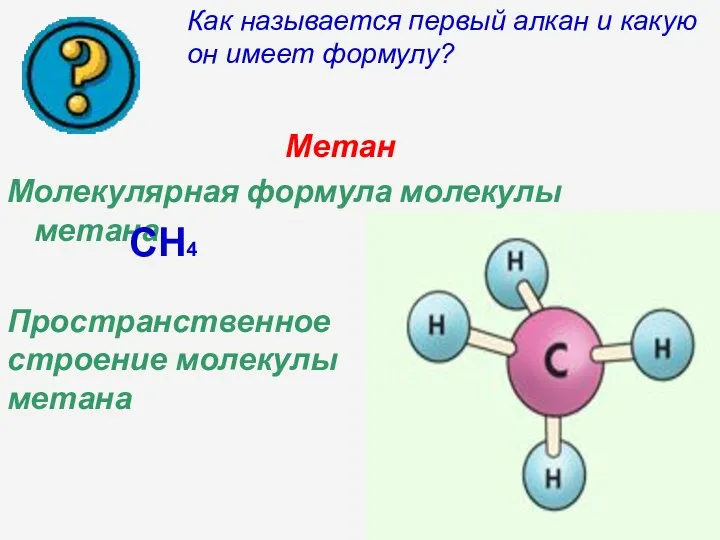
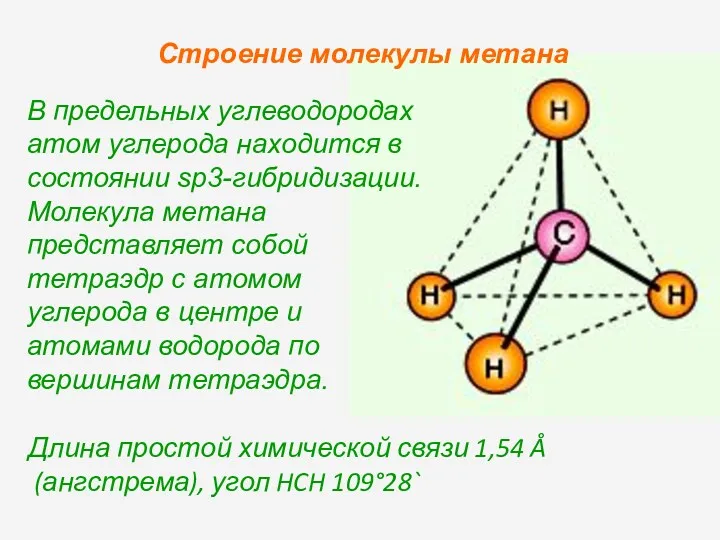
- 4. Метан Молекулярная формула молекулы метана CH4 Пространственное строение молекулы метана Как называется первый алкан и какую
- 5. Длина простой химической связи 1,54 Å (ангстрема), угол HCH 109°28` В предельных углеводородах атом углерода находится
- 7. Тема урока «Физические и химические свойства алканов» Определение углеводородов Определение алканов Номенклатура алканов Физические свойства Химические
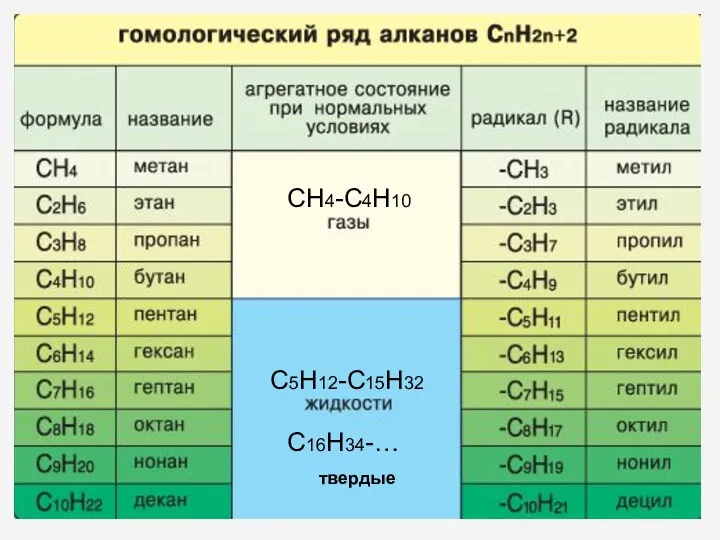
- 8. ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ Вспомните, какие вещества мы называем гомологами? ГОМОЛОГИ – это вещества со схожими строением
- 9. СН4-С4Н10 С5Н12-С15Н32 С16Н34-… твердые
- 10. Физические свойства Температуры плавленияТемпературы плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. МЕТАН – газ, без цвета и запаха, почти в 2 раза легче воздуха,
- 12. ЭТАН, ПРОПАН И БУТАН входят в состав природного и попутного нефтяного газов. АЛКАНЫ содержатся в нефти.
- 13. Химические свойства В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют
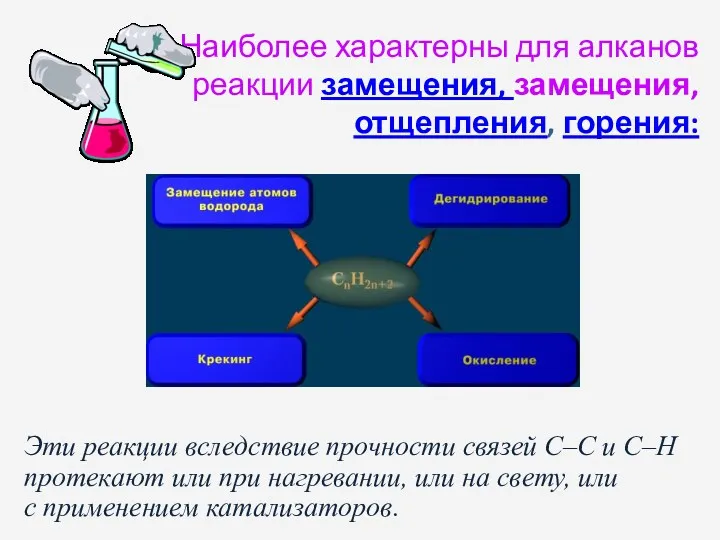
- 15. Наиболее характерны для алканов реакции замещения, замещения, отщепления, горения: Эти реакции вследствие прочности связей C–C и
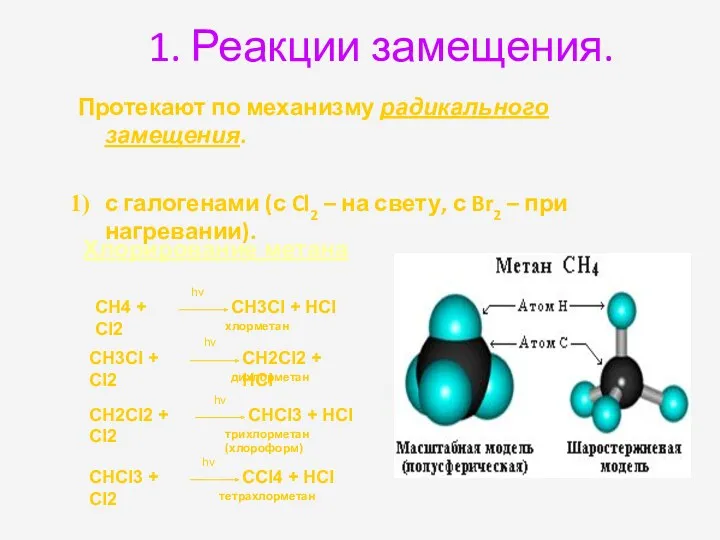
- 16. 1. Реакции замещения. Протекают по механизму радикального замещения. с галогенами (с Cl2 – на свету, с
- 17. Реакции галогенирования –замещение атома водорода атомом галогена. Замещение атома водорода галогеном легче всего идет у менее
- 18. CH4 + Cl2 → CH3Cl + HCl CH3Cl + Cl2 → CH2Cl2 + HCl CH2Cl2 +
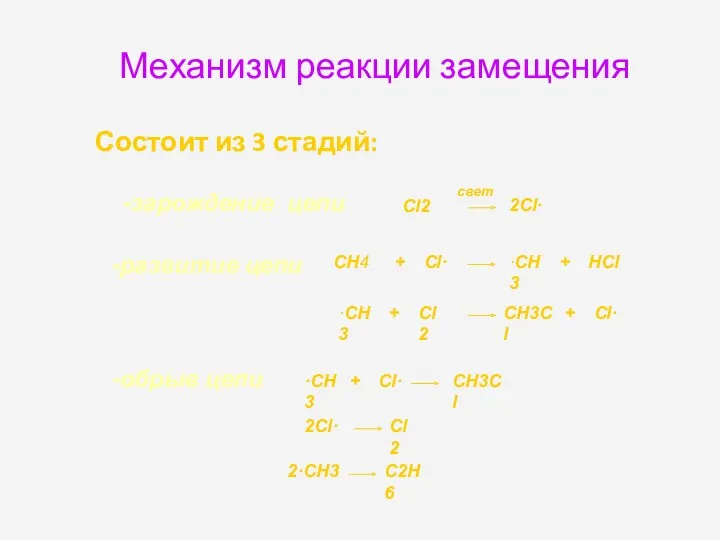
- 19. Механизм реакции замещения Состоит из 3 стадий: -зарождение цепи Cl2 2Cl· -развитие цепи CH4 + Cl·
- 20. Перед нами типичная цепная реакция… Теоретически хлорирование метана может идти до бесконечности, т.е. до тех пор
- 21. Запишите определение! Реакции, в результате которых происходит цепь последовательных превращений, называют цепными реакциями. (стр. 24)
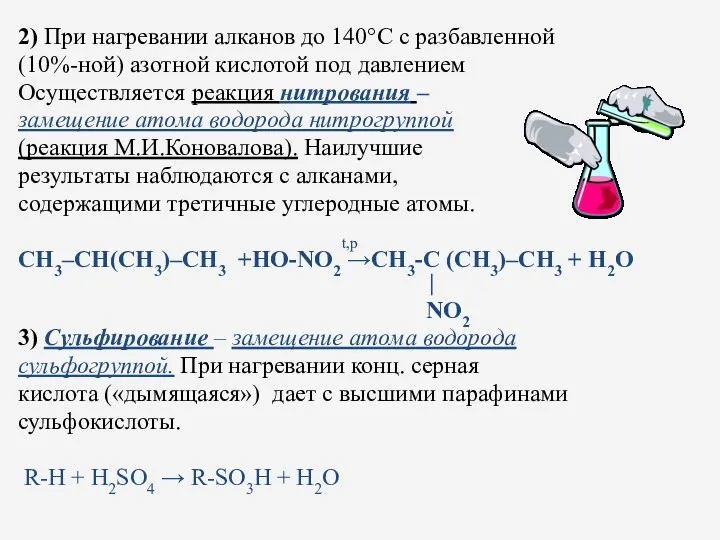
- 22. 2) При нагревании алканов до 140°С с разбавленной (10%-ной) азотной кислотой под давлением Осуществляется реакция нитрования
- 23. Запомните! Для алканов характерны реакции замещения атомов водорода на другие атомы или группы атомов. В этих
- 24. 2. Реакции отщепления. а) дегидрирование: CH3 – CH3 Pt,t° CH2=CH2 + H2 б) крекинг алканов: CH3
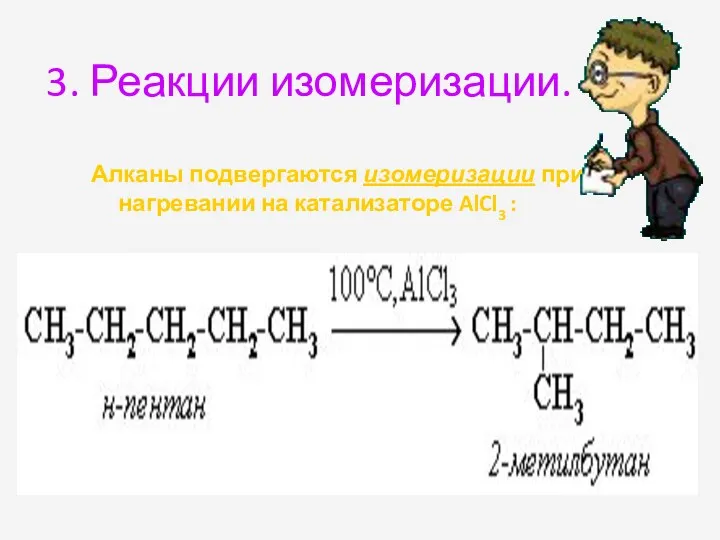
- 25. 3. Реакции изомеризации. Алканы подвергаются изомеризации при нагревании на катализаторе AlCl3 :
- 26. 4. Реакции окисления. а) все алканы горят с образованием углекислого газа и воды : б) при
- 29. Взрыв метана с кислородом Для полного сгорания метана на один объем метана нужно взять два объема
- 32. Запомните! Алканам характерны следующие химические реакции: 1. Реакции замещения; 2. Реакции отщепления; 3. Реакции изомеризации; 4.
- 33. Вопросы для самопроверки
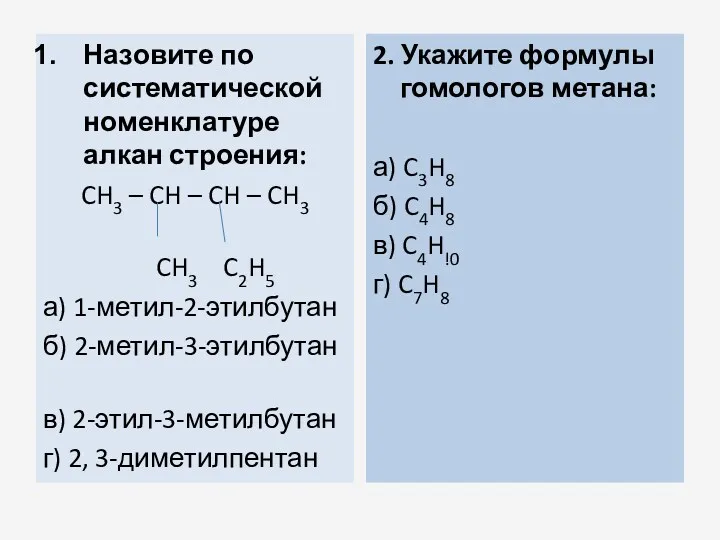
- 34. Назовите по систематической номенклатуре алкан строения: CH3 – CH – CH – CH3 CH3 C2H5 а)
- 35. 3. Каким соединениям даны неправильные названия? а) 2-метилпентан б) 2-этилбутан в) 1-метилпентан г) диметилбутан 4. Какое
- 36. 5. Какие характеристики применимы для описания реакции хлорирования этана? а) цепная б) свободнорадикальная в) протекает в
- 37. 7. В отличие от пропана бутан вступает в реакцию: а) горения в кислороде б) хлорирования при
- 38. Проверяем тест 1. Назовите по систематической номенклатуре алкан строения: б) 2, 3-диметилпентан 1 2 3 4
- 39. Проверяем тест 5. Какие характеристики применимы для описания реакции хлорирования этана? а) цепная 6. Для алканов
- 40. Выставляем оценки Оценка «5» – Выполнено: 7 - 8 з.; Оценка «4» – Выполнено: 5 -
- 41. В заключение – тест. 1. Узнал много нового. 2. Мне это пригодится в жизни. 3. Было
- 43. Скачать презентацию






























 Описание игры, Тактика игры в настольный теннис
Описание игры, Тактика игры в настольный теннис Тригонометрия. Вычисление и преобразование выражений. Занятие – консультация (11 класс)
Тригонометрия. Вычисление и преобразование выражений. Занятие – консультация (11 класс) Шаблон презентации - с днем Защитника
Шаблон презентации - с днем Защитника Детский травматизм
Детский травматизм Строевые упражнения
Строевые упражнения Гашишная наркомания. Зависимость от психостимуляторов
Гашишная наркомания. Зависимость от психостимуляторов Сталинградская битва 17 июля 1942 - 2 февраля 1943 г
Сталинградская битва 17 июля 1942 - 2 февраля 1943 г Презентация Генетическая связь неорганических веществ
Презентация Генетическая связь неорганических веществ Преобразование видеопотока в поток семантической информации
Преобразование видеопотока в поток семантической информации Жизнь и творчество Ф.И. Тютчева
Жизнь и творчество Ф.И. Тютчева Презентация Январские праздники для старших дошкольников
Презентация Январские праздники для старших дошкольников Готовность детей к школе
Готовность детей к школе Общие сведения об ПРВ. Структурная схема изделия 1РЛ130 (ПРВ-13)
Общие сведения об ПРВ. Структурная схема изделия 1РЛ130 (ПРВ-13) Вулканы. Гейзеры.
Вулканы. Гейзеры. Презентация к внеклассному мероприятию
Презентация к внеклассному мероприятию крестьянские хоромы
крестьянские хоромы Оформление библиографического списка
Оформление библиографического списка Басня И.А.Крылова Слон и Моська 2 класс
Басня И.А.Крылова Слон и Моська 2 класс Занятость и безработица. Рынок труда
Занятость и безработица. Рынок труда 20181030_prilozhenie_3
20181030_prilozhenie_3 Волонтерский отряд Лига добра
Волонтерский отряд Лига добра Комплексиметрическое титрование. (Лекция 12)
Комплексиметрическое титрование. (Лекция 12) Техника безопасности на уроках химии
Техника безопасности на уроках химии Test assignments
Test assignments Язык гипертекстовой разметки HTML 5: описание и основные элементы
Язык гипертекстовой разметки HTML 5: описание и основные элементы Урок Отраслевая структура хозяйства
Урок Отраслевая структура хозяйства Астероиды. Признаки астероидов
Астероиды. Признаки астероидов Особенности социально-экономического развития Франции во второй половине XIX – начале XX века
Особенности социально-экономического развития Франции во второй половине XIX – начале XX века