Слайд 14

Валентность у неметаллов:
У неметаллов проявляются в основном две валентности: высшая,
равная номеру группы, и низшая, равная разности между числом 8 и номером группы, в которой находится данный элемент. Например, сера S имеет высшую валентность 6 и низшую 2 (8-6=2), фосфор Р – валентности 5 и 3 (8-5 = 3)
1)При соединений неметаллов с металлами неметаллы проявляют низшую валентность.
Например, NaCl ( при соединении хлора с натрием хлор проявляет низшую валентность 1 )
2) При соединений неметаллов с водородом, также проявляют низшую валентность
3) При соединении неметалла с неметаллом, то высшую валентность проявит тот, кто стоит ближе к диагонали (границе), т.е. тот химический элемент , который стоит в таблице Менделеева ниже и левее. Например, при соединении серы и кислородом сера проявляет высшую валентность 6, а кислород – низшую 2. И кислород, и сера стоят в одном ряду, но сера стоит ниже кислорода, то есть ближе к диагонали. Или, например, при соединении кремния и углерода. Оба элемента стоят в одном ряду, но кремний находится ниже углерода, значит у него высшая валентность 4, а углерода низшая валентность, тоже 4 (8-4=4)
















 Оптика. Реальные оптические системы. Ограничения пучков. (Лекция 7)
Оптика. Реальные оптические системы. Ограничения пучков. (Лекция 7) Технология обслуживания устройства плавного пуска ПВИ-250 МВПП
Технология обслуживания устройства плавного пуска ПВИ-250 МВПП 20230707_1.a.svoystvo_stepeni_s_naturalnym_pokazatelem
20230707_1.a.svoystvo_stepeni_s_naturalnym_pokazatelem Руководство Пользователя - Qo’llanma User Guide
Руководство Пользователя - Qo’llanma User Guide Правила сравнения десятичных дробей. 5 класс
Правила сравнения десятичных дробей. 5 класс Сборник материалов для родителей Школа заботливых родителей
Сборник материалов для родителей Школа заботливых родителей Рыночный спрос. Закон спроса
Рыночный спрос. Закон спроса Детские поделки на Пасху: пасхальные цыплята, пасхальные курочки
Детские поделки на Пасху: пасхальные цыплята, пасхальные курочки Экологические сообщества
Экологические сообщества Презентация Усадьба фон-Дервиза в Кирицах
Презентация Усадьба фон-Дервиза в Кирицах Древние образы в народном искусстве. 5 класс
Древние образы в народном искусстве. 5 класс Менингококковая инфекция
Менингококковая инфекция Достопримечательности Калиниграда
Достопримечательности Калиниграда Исследовательская работа Анализ эффективности различных средств рекламы
Исследовательская работа Анализ эффективности различных средств рекламы Развитие связной речи. Тема Ландыши
Развитие связной речи. Тема Ландыши Шрифт TrueType (Primo) для прописей-текстов
Шрифт TrueType (Primo) для прописей-текстов Ship measurement. Test
Ship measurement. Test Серые лесные почвы
Серые лесные почвы Цемент. Свойства цемента
Цемент. Свойства цемента Способ подготовки кромок листового металла
Способ подготовки кромок листового металла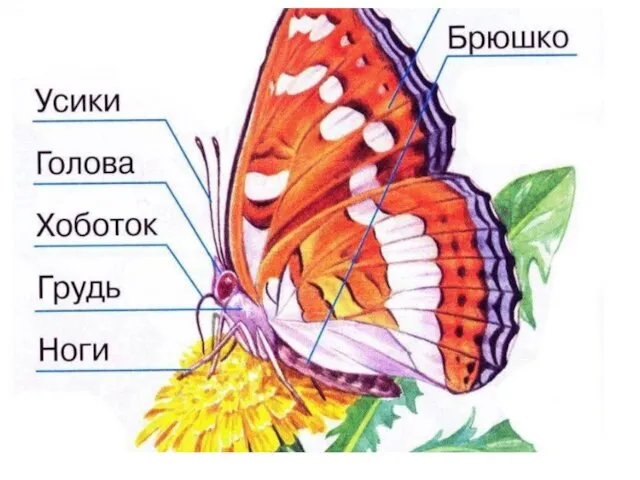 Матылі
Матылі Занятие по внеурочной деятельности. Школа здоровья. Советы доктора ВОДЫ
Занятие по внеурочной деятельности. Школа здоровья. Советы доктора ВОДЫ треугольник 2
треугольник 2 Разработка и исследование методов систем мониторинга работы станков с ЧПУ Ижевск
Разработка и исследование методов систем мониторинга работы станков с ЧПУ Ижевск Аускультация сердца и сосудов. Тоны и шумы сердца. Механизмы их возникновения и изменения при патологии
Аускультация сердца и сосудов. Тоны и шумы сердца. Механизмы их возникновения и изменения при патологии Здоровые зубы
Здоровые зубы Презентация к уроку Основание Санкт-Петербурга по внеурочной деятельности
Презентация к уроку Основание Санкт-Петербурга по внеурочной деятельности Особо охраняемые природные территории Киришского района
Особо охраняемые природные территории Киришского района