Содержание
- 2. Технологическая схема – рационально построенная система единичных аппаратов, соединённых различными видами связей, позволяющая получить заданный продукт
- 3. Технико-экономические показатели химико-технологических процессов Производительность Показателем, характеризующим эффективность работы машин, аппаратов, установок, цехов и заводов в
- 4. Интенсивность – это производительность, отнесённая к какой-либо величине, характеризующей размеры аппарата, - его объёму, площади поперечного
- 5. Степень превращения (степень конверсии) – это отношение количества реагента, вступившего в реакцию, к его исходному количеству.
- 6. Выход продукта – это отношение количества полученного целевого продукта к максимально возможному его количеству, которое могло
- 7. Селективностью (избирательностью) называется отношение количества исходного вещества, расходуемого на целевую реакцию, к общему количеству исходного вещества,
- 8. Расходным коэффициентом называют отношение количества сырья, материалов, топлива и энергии, затраченных на проведение химико-технологического процесса, к
- 9. Задание: Рассчитайте практический расходный коэффициент по природному газу (м3) в производстве ацетилена методом окислительного пиролиза, если
- 10. Себестоимость продукции – это денежное выражение затрат данного предприятия на изготовление и сбыт единицы продукции. Затраты
- 11. Задание: В реактор окисления толуола в бензойную кислоту загружают 40 тонн толуола, который занимает 75% объёма
- 12. Общие представления о каталитических реакциях Катализаторы – это вещества, которые увеличивают скорость реакции. Катализатор многократно участвует
- 13. Механизм действия катализатора. Катализатор направляет реакцию по другому пути, который требует меньших затрат энергии
- 14. Катализатор не изменяет ни энергии реагентов, ни энергии продуктов, следовательно, не влияет на состояние химического равновесия,
- 15. Каталитические процессы подразделяют на две большие группы: гомогенные и гетерогенные. Наибольшее распространение в промышленности получили гетерогенно-каталитические
- 16. Энергетическая диаграмма гетерогенно-каталитической реакции
- 17. Важной технологической характеристикой каталитического процесса является время контактирования (время контакта). Величина, обратная времени контакта, называется объёмной
- 18. Селективность (избирательность) катализатора – это свойство катализатора ускорять одну целевую реакцию из нескольких возможных. Если одновременно
- 20. Скачать презентацию
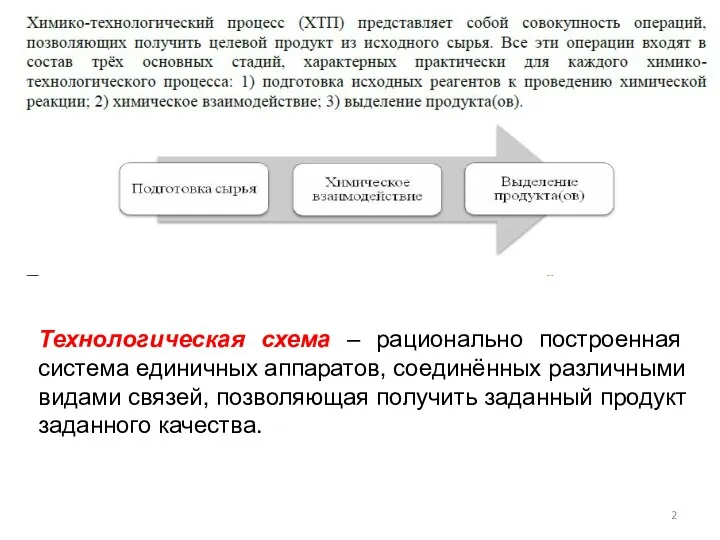




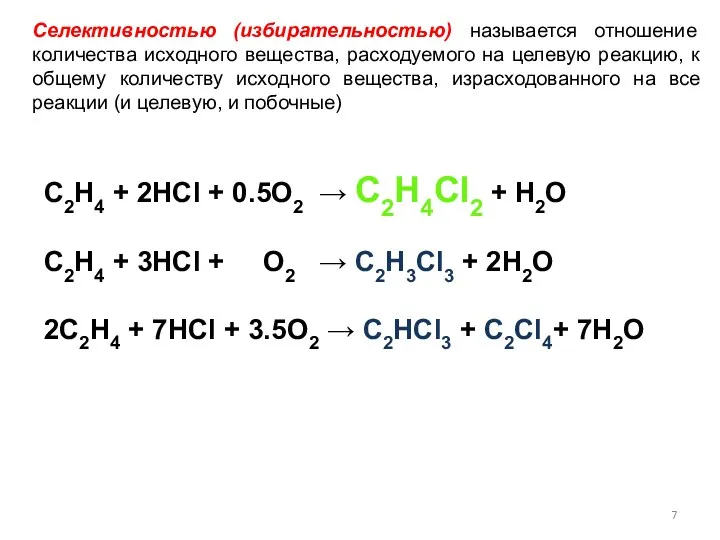




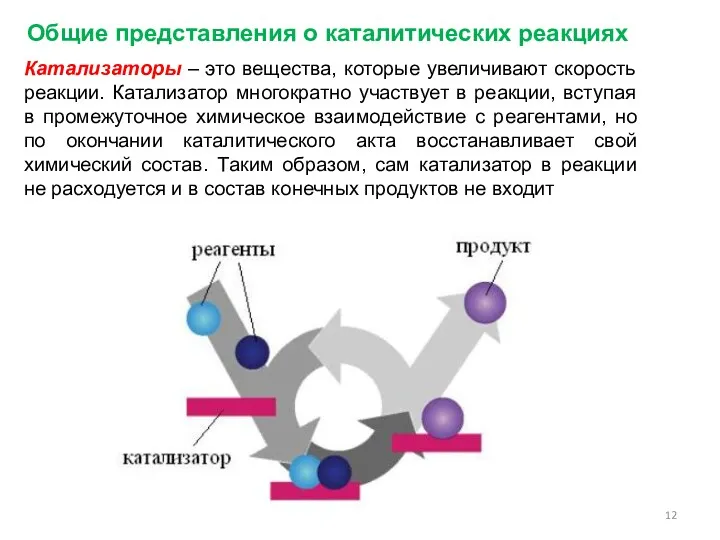
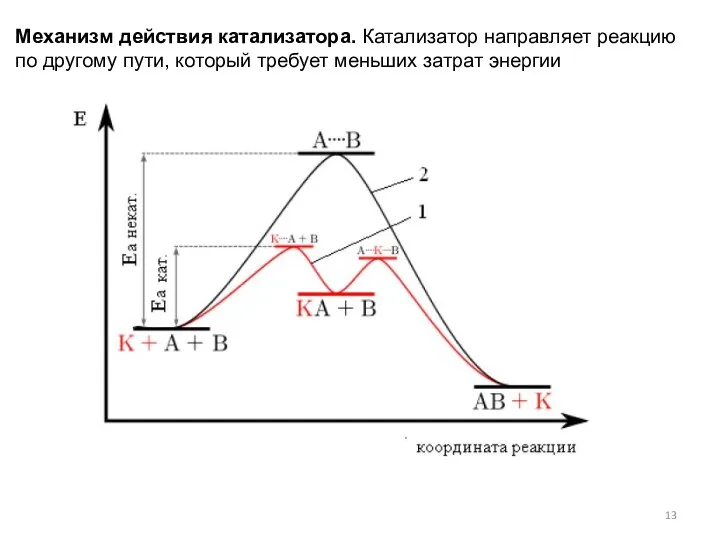

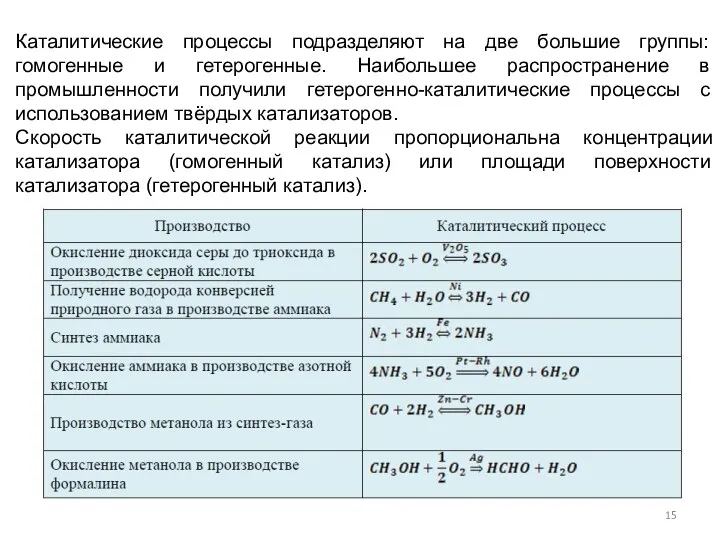
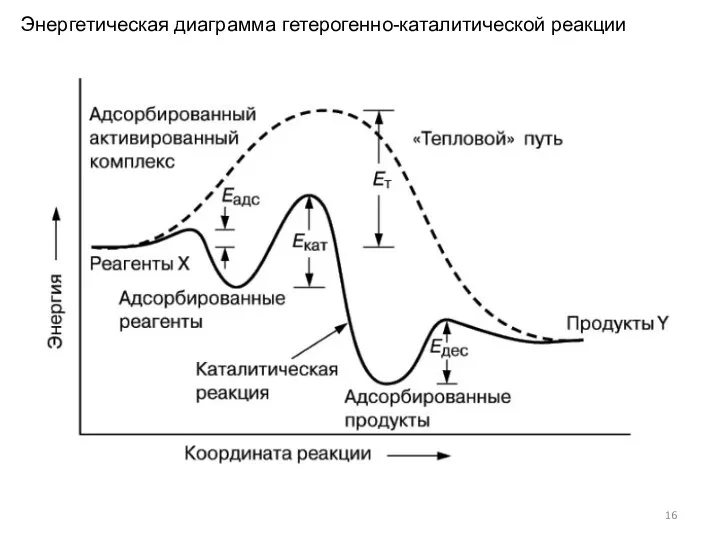


 Фото. Айсберг
Фото. Айсберг Остеоартроз (остеоартрит)
Остеоартроз (остеоартрит) Отчёт по работе Духовно-просветительского центра Глазовской епархии за 2019 год
Отчёт по работе Духовно-просветительского центра Глазовской епархии за 2019 год Storage devices
Storage devices Идеальные растворы. Законы Дальтона и Рауля
Идеальные растворы. Законы Дальтона и Рауля Исследовательский проект Красочные эксперименты.
Исследовательский проект Красочные эксперименты. Игры и задания на развитие интеллекта. 4 – 7 лет
Игры и задания на развитие интеллекта. 4 – 7 лет Трудовое право. Конвенция о правах ребенка. Конституция РФ. Трудовой кодекс РФ. Отдельные законы о труде
Трудовое право. Конвенция о правах ребенка. Конституция РФ. Трудовой кодекс РФ. Отдельные законы о труде Понятие об инфекционном процессе и инфекционных болезнях
Понятие об инфекционном процессе и инфекционных болезнях Датчики для метеостанции. Структурная и принципиальная схема разрабатываемой метеостанции. Конструкторские расчеты
Датчики для метеостанции. Структурная и принципиальная схема разрабатываемой метеостанции. Конструкторские расчеты Полеты в космос
Полеты в космос Простое оштукатуривание стен строительного склада цементным раствором и ремонт облицовки пола керамической метлахской плиткой
Простое оштукатуривание стен строительного склада цементным раствором и ремонт облицовки пола керамической метлахской плиткой Машинобудування та металообробка Харківської області
Машинобудування та металообробка Харківської області История России в первой половине ХХ века
История России в первой половине ХХ века Народная игрушка
Народная игрушка Сочинение на тему Чем мне запомнилась картина Валентина Александровича Серова Мика Морозов
Сочинение на тему Чем мне запомнилась картина Валентина Александровича Серова Мика Морозов Презентация Я-лидер.
Презентация Я-лидер. Профессия воспитатель
Профессия воспитатель Безработица в России: типы, социальна структура, особенности динамики в условиях формирования цифровой экономики
Безработица в России: типы, социальна структура, особенности динамики в условиях формирования цифровой экономики Death by PowerPoint (and how to fight it)
Death by PowerPoint (and how to fight it) Природные ресурсы земной коры
Природные ресурсы земной коры Свойства числовых неравенств
Свойства числовых неравенств Презентация русско-французского образовательного проекта Защитим окружающий мир вместе
Презентация русско-французского образовательного проекта Защитим окружающий мир вместе Удивительные доисторические животные Южной Америки
Удивительные доисторические животные Южной Америки Слоговая структура слова 4-го типа в предложениях
Слоговая структура слова 4-го типа в предложениях Характеристика, типы и виды волос и ногтей. Основы строения и физиологии кожи, волос и ногтей
Характеристика, типы и виды волос и ногтей. Основы строения и физиологии кожи, волос и ногтей Методический семинар Создание персонального сайта учителя
Методический семинар Создание персонального сайта учителя Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)