Слайд 2

Определение
Химия- наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих
эти превращения.
Слайд 3

Основные понятия химии
Вещество
Молекулы и атомы
Химический элемент
Химическая формула
Валентность
Химическое уравнение
Моль
Оксид, кислота, основание, соль.
Раствор
Степень
окисления
Слайд 4

Слайд 5
Слайд 6

Слайд 7
Слайд 8

Слайд 9

Слайд 10

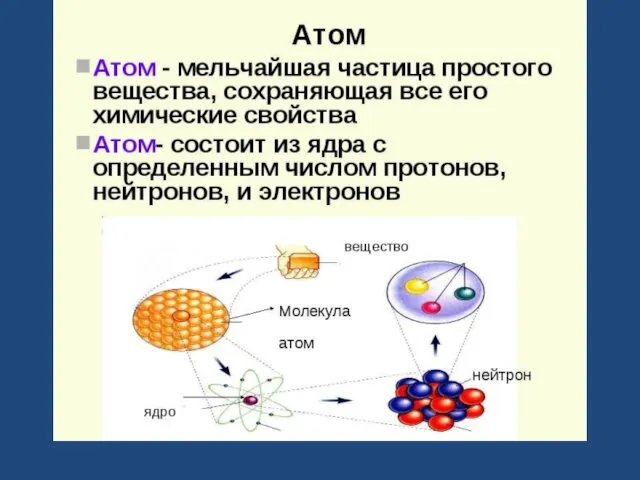
Строение атома
Атом- мельчайшая химически неделимая электронейтральная частица вещества.
В центре атома находится
положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны.
Виды элементарных частиц: протоны (р), нейтроны (n), электроны (е).
Общее число протонов и нейтронов в ядре атома называют массовым числом (А). А= N + Р
Химический элемент- вид атомов с определенным зарядом ядра.
Изотопы- разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов в ядре, но разную массу.
Слайд 11

Строение атома
Изотопы отличаются друг от друга числом нейтронов в ядре.
Порядковый
номер химического элемента показывает: число протонов в ядре ( заряд ядра) и общее число электронов в атоме.
Номер периода показывает число энергетических уровней в атоме.
Номер группы- число электронов на последнем энергетическом уровне ( для элементов главных подгрупп).
Слайд 12

Периодический закон
Д.И. Менделеева
Свойства химических элементов и образуемых ими простых и
сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов
Слайд 13

Строение периодической системы
Периодическая система Менделеева- графическое отображение периодического закона.
В ней 7
периодов, 10 рядов, 8 групп. Каждая группа состоит из 2 подгрупп- главной и побочной.
Каждый период начинается щелочными металлами и заканчивается инертными элементами.
В главных подгруппах (сверху вниз) с увеличением относительных атомных масс усиливаются металлические свойства элементов и ослабевают неметаллические.
Слайд 14
Слайд 15

Химические явления (химические реакции)
Слайд 16

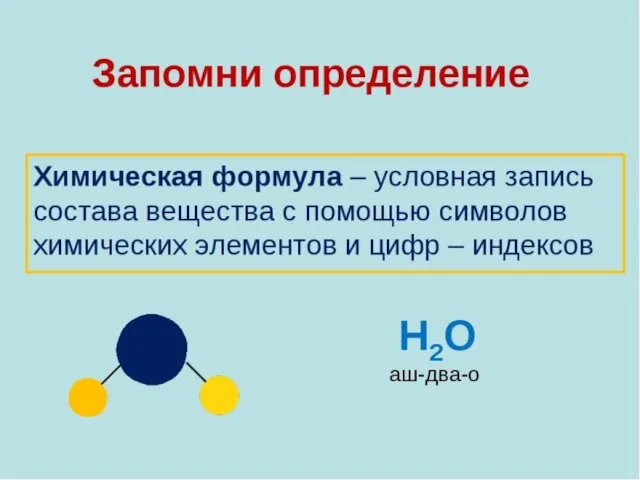
Химическая формула
Химическая формула – это условная запись состава вещества посредством химических
знаков и индексов.
СаСО3 , Н2SO4 , СО2 , КОН
Слайд 17

Химическое уравнение
Химическим уравнением называют условную запись химической реакции посредством химических знаков
и формул
2Н2 + О2 = 2Н2О
Слайд 18

Классификация химических реакций
По числу и составу исходных и образующихся веществ
Слайд 19

Индикаторы
Индикаторы – вещества, которые под действием растворов кислот и щелочей изменяют
свой цвет
Лакмус, метиловый оранжевый, фенолфталеин
Слайд 20

Законы химии
Закон сохранения массы веществ
Закон постоянства состава веществ
Закон Авогадро
Периодический закон
Слайд 21

Закон сохранения массы веществ
Масса веществ, вступивших в химическую реакцию,
равна массе
образовавшихся веществ
Слайд 22

Закон постоянства состава веществ
Каждое химически чистое вещество независимо от места нахождения
и способа получения
имеет один и тот же
постоянный состав.
Слайд 23

Закон Авогадро
Равные объемы
любых газов
(при одинаковых температуре и давлении)
содержат
равное число молекул.
Слайд 24

Периодический закон
Свойства простых веществ,
а также формы
и свойства соединений элементов
находятся
в периодической зависимости
от величины заряда ядра атома (порядкового номера).
Слайд 25
Классы неорганических соединений
Слайд 26
Слайд 27
Химические свойства основных оксидов
Слайд 28
Химические свойства кислотных оксидов
Слайд 29
Слайд 30

Химические свойства щелочей
1. Щелочь + кислота = соль + вода
NaOH
+ HCL = NaCL + H2O
2. Щелочь + кислотный оксид = соль + вода
2КОН + СО2 = К2СО3 + Н2О
3. Щелочь + соль1 = соль2 + основание
3NaOH + FeCL3 = 3NaCL + Fe(OH)3
Слайд 31

Химические свойства нерастворимых оснований
Нераст. осн. + кислота = соль + вода
Cu(OH)2 + 2HCL = CuCL2 + 2H2O
Нераст. осн. разлагаются при нагревании.
Сu(OH)2 = CuO + H2O
Слайд 32
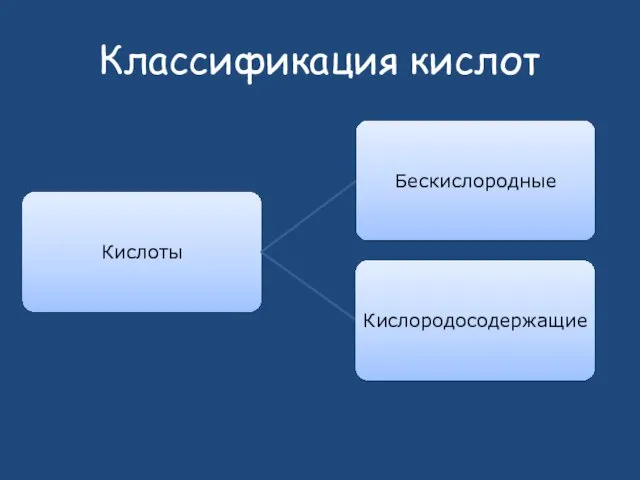
Слайд 33

Химические свойства кислот
Изменяют цвет индикаторов
С металлами
С основными оксидами
С основаниями
С солями (
более слабых и летучих кислот)
Некоторые кислоты разлагаются при нагревании
Слайд 34

Классификация солей
Средние (нормальные) – К2СО3
Кислые – КНСО3
Основные – Mg(OH)CL
Двойные – К2NaPO4
Комплексные
– Na2Zn(OH)4
Слайд 35

Химические свойства солей
Соль + кислота = другая соль+ другая кислота
К2СО3 +2 НСL = 2 КСL + СО2 + Н2О
Соль + щелочь = другая соль + другое основание
СuSO4 +2 NaOH =Cu(OH)2 + Na2SO4
Соль1 + соль2 = соль3 + соль4
Cu(NO3)2 + Na2CO3 = CaCO3 +2NaNO3
Соль + металл = другая соль + другой металл
CuSO4 + Fe = Cu + FeSO4
Слайд 36

Генетическая связь между классами неорганических соединений
Генетический ряд металлов
1.Металл- основный оксид-
основание (щелочь)- соль
Са- СаО- Са(ОН)2 –Са3(РО4)2
2. Металл- основный оксид- соль- основание- основный оксид- металл
Cu- CuO- CuCL2- Cu(OH)2- CuO- Cu
Слайд 37

Генетическая связь между классами неорганических соединений
Генетический ряд неметаллов
Неметалл- кислотный оксид-
кислота- соль
Слайд 38

Проверь свои знания
Напиши формулы веществ: карбонат калия, оксид натрия, серная кислота,
гидроксид кальция, хлорид магния, нитрат алюминия, сульфат железа (III), сульфид натрия, сульфит калия, гидроксид цинка.





































 Презентация к уроки технологии в 3 классе Работа с тканью
Презентация к уроки технологии в 3 классе Работа с тканью Отражения. Принцип построения отражений
Отражения. Принцип построения отражений Классный час Мир моих увлечений 2-3 класс
Классный час Мир моих увлечений 2-3 класс Вавилонский царь Хаммурапи и его законы
Вавилонский царь Хаммурапи и его законы Социальное проектирование
Социальное проектирование هوش مصنوعی
هوش مصنوعی BL BOSCH 5.3 ABS. System Description of BL ABS
BL BOSCH 5.3 ABS. System Description of BL ABS Презентация подвиг во имя жизни
Презентация подвиг во имя жизни Презентация кружка Волшебные краски 2 часть
Презентация кружка Волшебные краски 2 часть Моделирование плечевого изделия с цельнокроеным рукавом. 6 класс
Моделирование плечевого изделия с цельнокроеным рукавом. 6 класс Сказочная страна (ИЗО)
Сказочная страна (ИЗО) Мы за здоровый образ жизни. Познавательный час
Мы за здоровый образ жизни. Познавательный час Создание функций из массива данных. Интерполяция. Регрессия. Прикладные методы расчета и программные комплексы (4)
Создание функций из массива данных. Интерполяция. Регрессия. Прикладные методы расчета и программные комплексы (4) Консультация для воспитателей Развитие фонематического слуха у детей дошкольного возраста
Консультация для воспитателей Развитие фонематического слуха у детей дошкольного возраста Архитектура персонального компьютера
Архитектура персонального компьютера Монтаж установки предварительной очистки ППФ. Монтаж установки очистки пропилена от каталитических ядов
Монтаж установки предварительной очистки ППФ. Монтаж установки очистки пропилена от каталитических ядов Западная Европа в ХI-ХIII веках. Инквизиция и крестовые походы
Западная Европа в ХI-ХIII веках. Инквизиция и крестовые походы Учимся рисовать ракету
Учимся рисовать ракету Многоатомные спирты
Многоатомные спирты Политико-правовые идеи Древней Греции
Политико-правовые идеи Древней Греции Фото
Фото Электротехнические комплексы
Электротехнические комплексы Общественное движение при Александре I
Общественное движение при Александре I Медиаторы нервной системы
Медиаторы нервной системы Нейрон. Его свойства и функции
Нейрон. Его свойства и функции Теоретические основы реструктуризации
Теоретические основы реструктуризации Кто говорит, что на войне не страшно, тот ничего не знает о войне. 9 мая - День Победы
Кто говорит, что на войне не страшно, тот ничего не знает о войне. 9 мая - День Победы Черная металлургия России. Изделия из чугуна и стали
Черная металлургия России. Изделия из чугуна и стали