Содержание
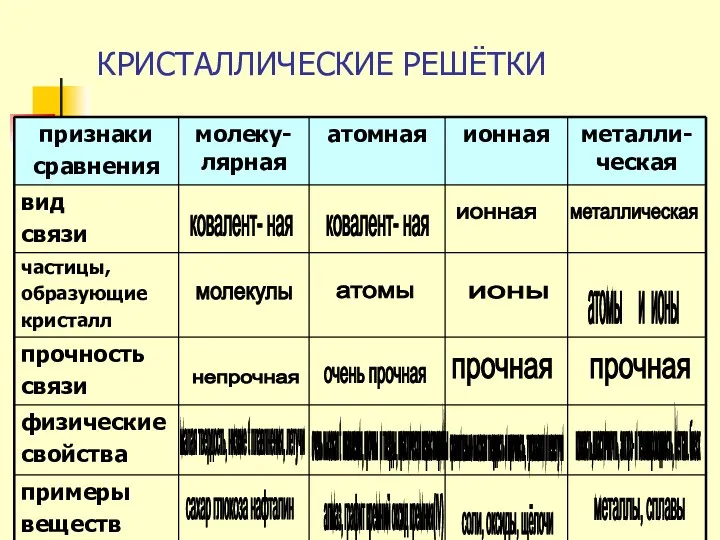
- 2. КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ ковалент- ная молекулы непрочная малая твердость, низкие t плавлнения, летучи сахар глюкоза нафталин ковалент-
- 3. Выбрать правильный ответ. 1. Ионную кристаллическую решётку имеет вещество, формула которого а) SiО2; б) О2, в)
- 4. Тестирование. Определите, о какой кристаллической решётке идет речь, разделите утверждения на 4 группы: Атомные: Молекулярные: Ионные:
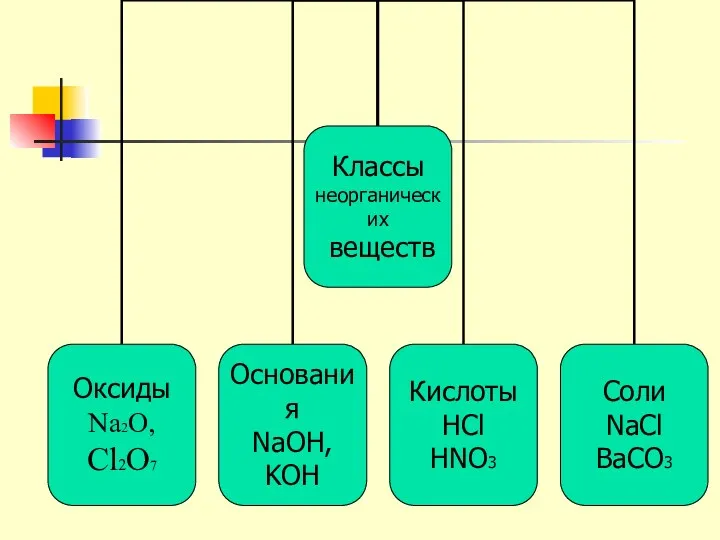
- 5. Классы неорганических соединений
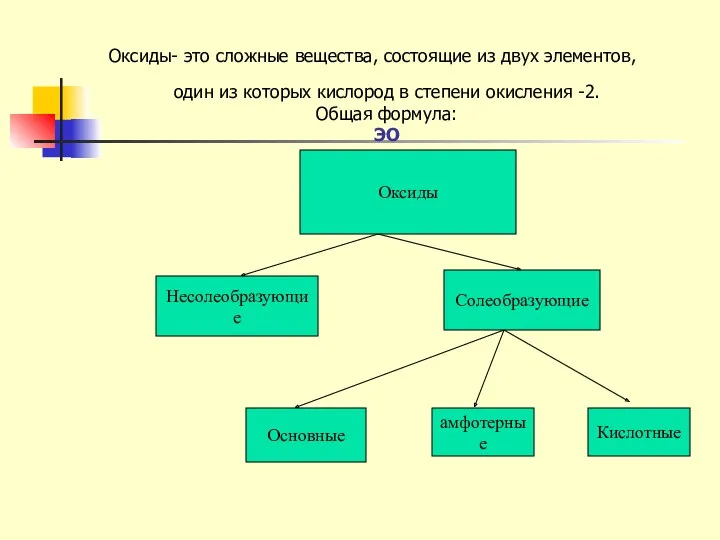
- 7. Оксиды Несолеобразующие Солеобразующие Основные амфотерные Кислотные Оксиды- это сложные вещества, состоящие из двух элементов, один из
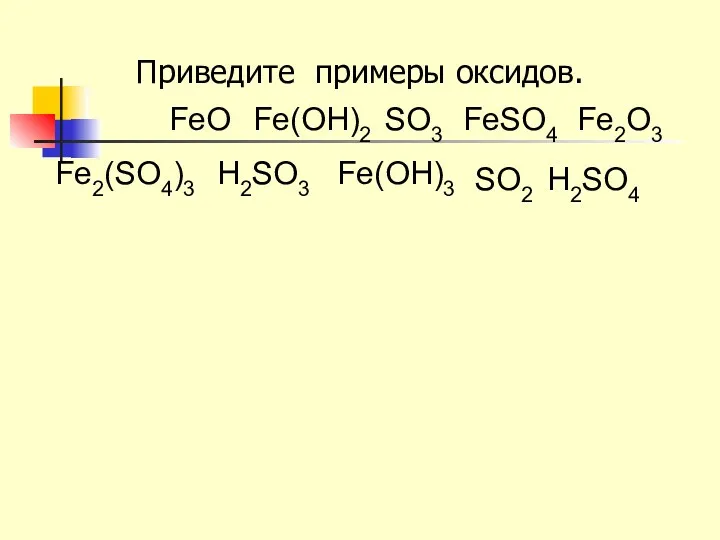
- 8. Приведите примеры оксидов. H2SO4 FeO Fe(OH)2 SO3 FeSO4 Fe2O3 Fe2(SO4)3 H2SO3 Fe(OH)3 SO2
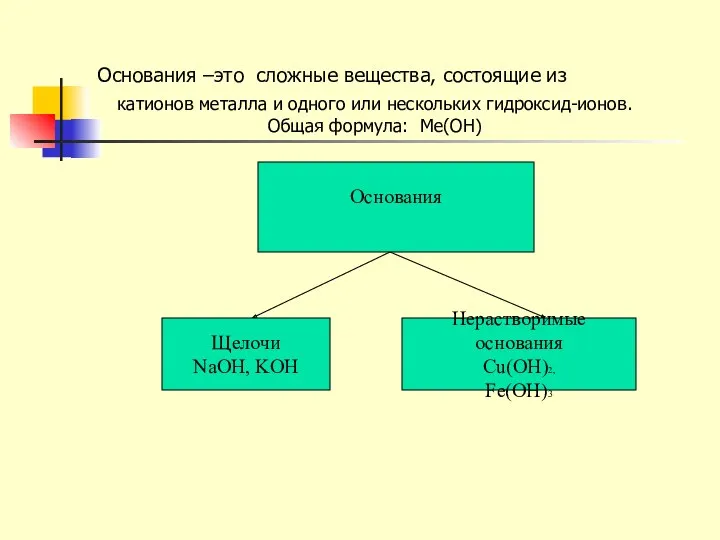
- 9. Основания –это сложные вещества, состоящие из Основания Щелочи NaOH, KOH Нерастворимые основания Cu(OH)2, Fe(OH)3 катионов металла
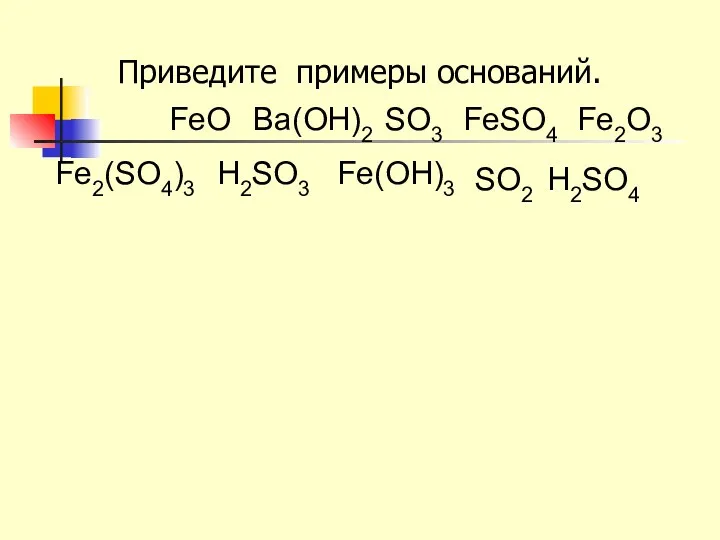
- 10. Приведите примеры оснований. H2SO4 FeO Ва(OH)2 SO3 FeSO4 Fe2O3 Fe2(SO4)3 H2SO3 Fe(OH)3 SO2
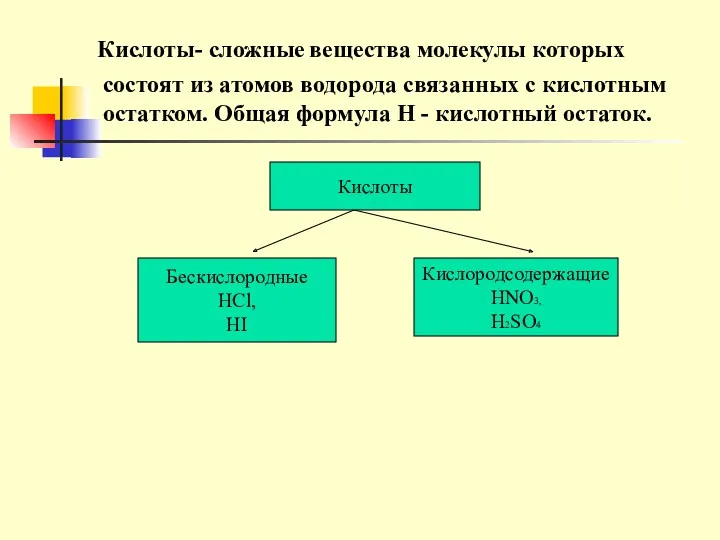
- 11. Кислоты- сложные вещества молекулы которых Кислоты Бескислородные НСl, HI Кислородсодержащие HNO3, H2SO4 состоят из атомов водорода
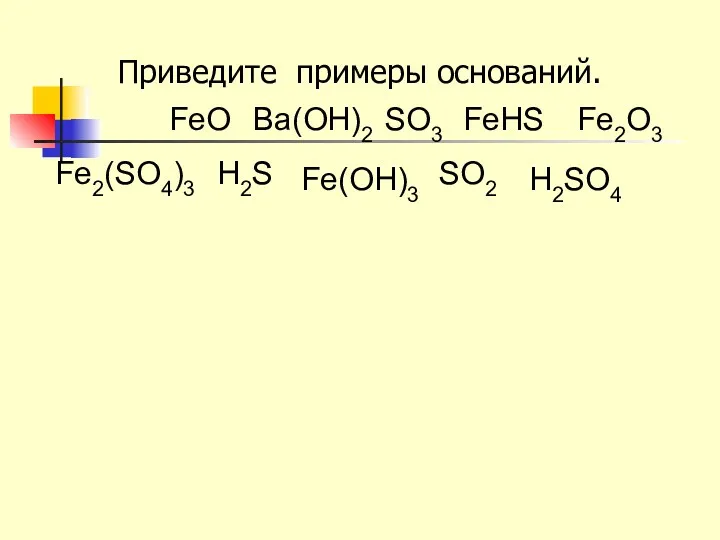
- 12. Приведите примеры оснований. H2SO4 FeO Ва(OH)2 SO3 FeНS Fe2O3 Fe2(SO4)3 H2S Fe(OH)3 SO2
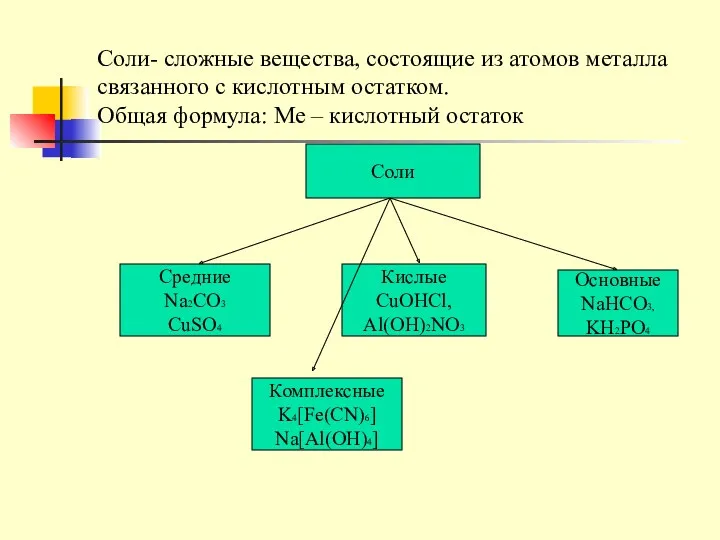
- 13. Соли- сложные вещества, состоящие из атомов металла связанного с кислотным остатком. Общая формула: Ме – кислотный
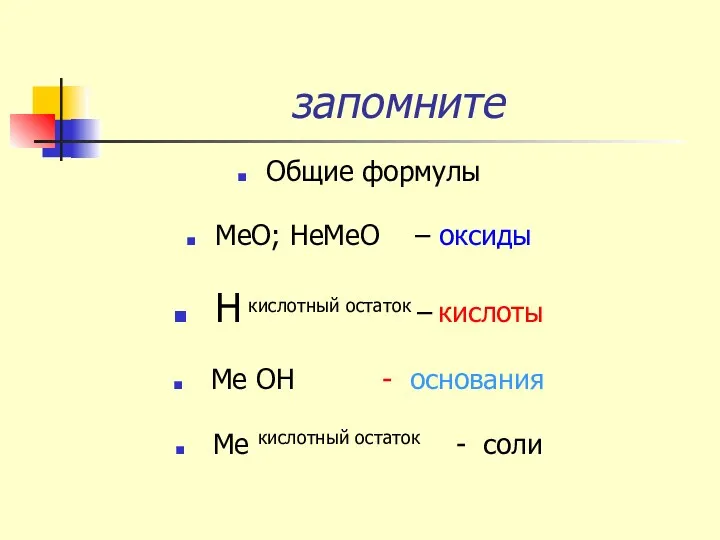
- 14. запомните Общие формулы МеО; НеМеО – оксиды Н кислотный остаток – кислоты Ме ОН - основания
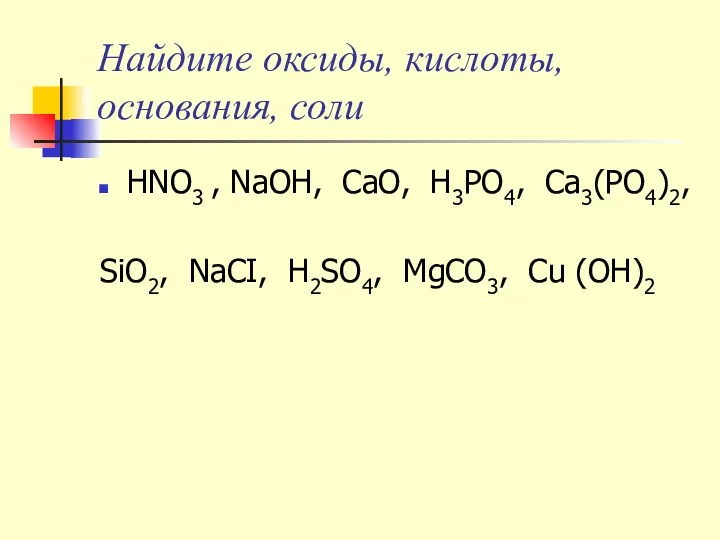
- 15. Найдите оксиды, кислоты, основания, соли HNO3 , NaOH, CaO, H3PO4, Ca3(PO4)2, SiO2, NaCI, H2SО4, MgCO3, Cu
- 16. Проверьте себя и оцените Оксиды: CaO –оксид кальция, SiO2 оксид кремния ; Кислоты: HNO3 азотная кислота
- 17. 1.Найдите в каждом ряду «лишнее» вещество и объясните свой выбор:
- 18. Проверь себя NO – несолеобразующий оксид Zn(OH)2 – амфотерное основание H22SO4 – кислота NaOH – основание
- 19. Генетическая связь между классами неорганических веществ
- 20. Генетический ряд металла Cu → CuO → Cu SO4 Генетический ряд неметалла S → SO3 →
- 21. 2.Составьте схему генетической связи между веществами:
- 22. Проверь себя
- 23. Домашнее задание §30-33 № 10 (а,е) стр.112 Распределить вещества по классам и назвать их
- 25. Скачать презентацию











 Презентация экологического проекта
Презентация экологического проекта Построение графика квадратичной функции
Построение графика квадратичной функции Организация работы холодного цеха
Организация работы холодного цеха Родительское собрание Мой ребёнок становится трудным…
Родительское собрание Мой ребёнок становится трудным… Причастие. Значение, морфологические признаки, образование, синтаксическая роль
Причастие. Значение, морфологические признаки, образование, синтаксическая роль Matrices
Matrices Талисманы Олимпийских игр в Сочи
Талисманы Олимпийских игр в Сочи Автоматизированный комплекс обработки полетной информации, разработка алгоритма диагностирования противообледенительной системы
Автоматизированный комплекс обработки полетной информации, разработка алгоритма диагностирования противообледенительной системы материал к уроку обобщения Типы химических реакций Диск
материал к уроку обобщения Типы химических реакций Диск Виды электрического кабеля
Виды электрического кабеля Презентация к уроку технологии 2 класс Оригами. Собачка.
Презентация к уроку технологии 2 класс Оригами. Собачка. С днем рождения
С днем рождения Обобщающий урок. Позвоночные
Обобщающий урок. Позвоночные Фотография — искусство светописи. Вещь: свет и фактура
Фотография — искусство светописи. Вещь: свет и фактура Начало правления Ивана IV. Реформы избранной рады
Начало правления Ивана IV. Реформы избранной рады Элементы метода бухгалтерского учета
Элементы метода бухгалтерского учета Рассмотрение вариантов вывоза нефтепродуктов различными видами транспорта
Рассмотрение вариантов вывоза нефтепродуктов различными видами транспорта Виды воздушных шариков
Виды воздушных шариков А песни тоже воевали
А песни тоже воевали Издержки и прибыль предприятия
Издержки и прибыль предприятия Земляные работы на строительной площадке
Земляные работы на строительной площадке Минаев Дмитрий Дмитриевич (1835-1889)
Минаев Дмитрий Дмитриевич (1835-1889) Вода- самое удивительное вещество в природе.
Вода- самое удивительное вещество в природе. Турнир знатоков географии
Турнир знатоков географии Конструкции многоэтажных зданий. Здания со стенами из крупных панелей
Конструкции многоэтажных зданий. Здания со стенами из крупных панелей Функциональная схема ЭВМ. Лекция 3
Функциональная схема ЭВМ. Лекция 3 Шаблоны. Инфоповоды по проекту. Рекомендации для предприятий
Шаблоны. Инфоповоды по проекту. Рекомендации для предприятий воздушный транспорт
воздушный транспорт