Содержание
- 2. ФИЗИЧЕСКАЯ ХИМИЯ Наука о закономерностях химических процессов и химических явлений. Объясняет эти явления на основе фундаментальных
- 3. ФИЗИЧЕСКАЯ ХИМИЯ Задачи: - изучение строения и свойств вещества и составляющих его частиц изучение процессов взаимодействия
- 4. Основные разделы Строение вещества Химическая термодинамика Химическая кинетика и равновесие Учение о растворах Электрохимия Коллоидная химия
- 5. Все разделы физической химии объединяет единая основа – общие законы природы, которые применимы к любым процессам
- 6. ФИЗИЧЕСКАЯ ХИМИЯ Основоположник - М. В. Ломоносов (1711-1765)
- 7. ФИЗИЧЕСКАЯ ХИМИЯ Внесли огромный вклад в развитие науки – Карно, Джоуль, Гесс, Клаузиус, Гиббс, Вант-Гофф, Нернст
- 8. ФИЗИЧЕСКАЯ ХИМИЯ Многие специальные дисциплины (агрохимия, физиология растений и животных, биохимия, микробиология) на современном уровне не
- 9. ФИЗИЧЕСКАЯ ХИМИЯ Особое значение физической химии состоит в формировании у студентов диалектико-материалистического мировоззрения, которое обеспечивает наиболее
- 10. Строение вещества Молекулярно-кинетическая теория объясняет свойства тел взаимодействием и движением молекул и атомов В зависимости от
- 11. Агрегатные состояния Газообразное состояние идеальный газ - в котором можно пренебречь силами молекулярного взаимодействия и объемом
- 12. Агрегатные состояния Плазменное состояние частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов
- 13. Агрегатные состояния Жидкое состояние вещества Поверхностное натяжение - сила, которая стремится уменьшить площадь поверхности раздела Вязкость
- 14. Агрегатные состояния Твердое состояние вещества Типы кристаллических решеток триклинная моноклинная ромбическая гексагональная тетрагональная тригональная кубическая
- 15. Лекция № 2 Тема: Основы химической термодинамики
- 16. Химическая термодинамика Нулевым (или общим) началом термодинамики называют принцип, согласно которому замкнутая система независимо от начального
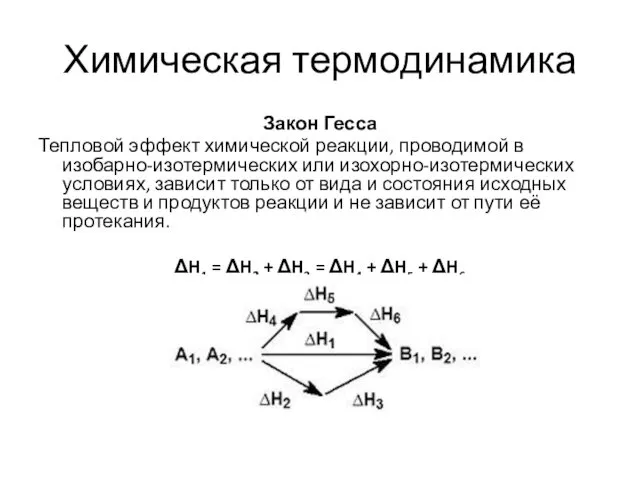
- 17. Химическая термодинамика Закон Гесса Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только
- 18. Химическая термодинамика Следствия из закона Гесса Тепловой эффект прямой реакции равен по величине и противоположен по
- 20. Скачать презентацию
















 Воспалительные заболевания кишечника: неспецифический язвенный колит и болезнь Крона
Воспалительные заболевания кишечника: неспецифический язвенный колит и болезнь Крона Формы объединений предприятий
Формы объединений предприятий Исследовательская работа Зевота: что это такое и так ли она заразительна Введение Глава 2. Причины появления зевоты Интересные факты о зевоте ·Обычный зевок, в среднем, по времени длится 6 секунд. Глава 3. Заразительность зевоты
Исследовательская работа Зевота: что это такое и так ли она заразительна Введение Глава 2. Причины появления зевоты Интересные факты о зевоте ·Обычный зевок, в среднем, по времени длится 6 секунд. Глава 3. Заразительность зевоты  Объединение компьютеров в локальную сеть. Организация работы пользователей в локальных сетях
Объединение компьютеров в локальную сеть. Организация работы пользователей в локальных сетях Программы инновационного развития госкомпаний
Программы инновационного развития госкомпаний British pop rock band Take That
British pop rock band Take That Рекомендации по бизнес - планированию малых форм хозяйствования
Рекомендации по бизнес - планированию малых форм хозяйствования Электрические машины переменного тока
Электрические машины переменного тока Урок-презентация кронштадт
Урок-презентация кронштадт Презентация Развитие интеллектуальных способностей дошкольников посредством развивающих игр Дьенеша
Презентация Развитие интеллектуальных способностей дошкольников посредством развивающих игр Дьенеша Обоснование максимальной депрессии. Условия добычи нефтяного месторождения
Обоснование максимальной депрессии. Условия добычи нефтяного месторождения Социология конфликта. Понятие и сущность конфликта, причины конфликтности в обществе
Социология конфликта. Понятие и сущность конфликта, причины конфликтности в обществе Різноманітність рептилій
Різноманітність рептилій Презентация Квиллинг
Презентация Квиллинг Трансцендентальна медитація
Трансцендентальна медитація Возбудитель сифилиса
Возбудитель сифилиса Elaborareaşi şi optimizarea programului de selecţie globală a dovinelor
Elaborareaşi şi optimizarea programului de selecţie globală a dovinelor Рождество Пресвятой Богородицы
Рождество Пресвятой Богородицы Найцікавіші битви часів Наполеону
Найцікавіші битви часів Наполеону Маленькие герои большой войны
Маленькие герои большой войны Sports
Sports Гидроочистка нефтяных фракций
Гидроочистка нефтяных фракций Религия. Иудаизм
Религия. Иудаизм Методы интенсификации добычи нефти
Методы интенсификации добычи нефти Игровая деятельность аутичного ребенка
Игровая деятельность аутичного ребенка Посттравматическое стрессовое расстройство. (ПТСР)
Посттравматическое стрессовое расстройство. (ПТСР) Сообщающиеся сосуды
Сообщающиеся сосуды Национальные виды спорта
Национальные виды спорта