Содержание
- 2. Строение и свойства атомов Элементы главной подгруппы VII группы Периодической системы Д. И. Менделеева, объединенные под
- 3. Галогены — очень сильные окислители. Фтор в химических реакциях проявляет только окислительные свойства, и для него
- 4. Галогены — простые вещества Все галогены существуют в свободном состоянии в виде двухатомных молекул с ковалентной
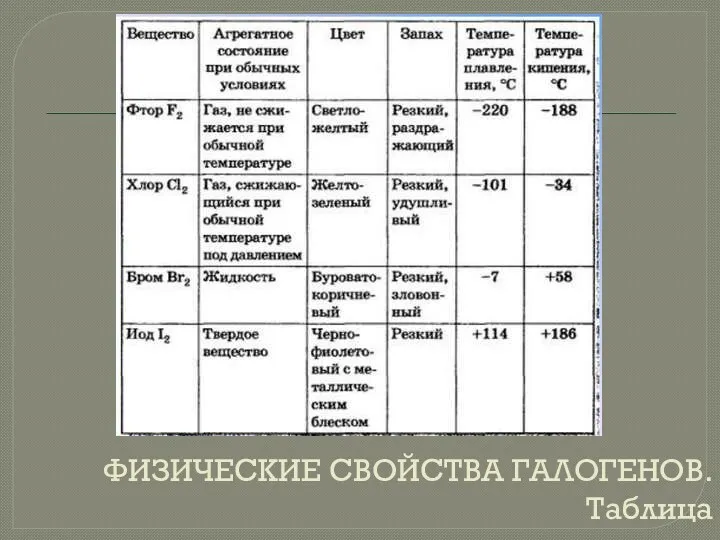
- 5. ФИЗИЧЕСКИЕ СВОЙСТВА ГАЛОГЕНОВ. Таблица
- 6. Окислительные свойства галогенов Каждый галоген является самым сильным окислителем в своем периоде. Окислительные свойства галогенов отчетливо
- 7. Остальные галогены реагируют с металлами в основном при нагревании. Так, в колбе, наполненной хлором, красиво вспыхивают
- 8. Нагретый порошок железа также загорается при взаимодействии С хлором. Опыт МОЖ- Рис. 50. Горение сурьмы но
- 9. Йод окисляет металлы медленнее, но в присутствии воды, которая является катализатором, реакция йода с порошком алюминия
- 10. Об уменьшении окислительных и увеличении восстановительных свойств галогенов от фтора к йоду можно судить и по
- 11. Для фтора эта реакция не характерна, так как она протекает в растворе, а фтор взаимодействует с
- 12. Если фтор взаимодействует с водородом в любых условиях со взрывом, то смесь хлора с водородом реагирует
- 13. Открытие галогенов Фтор в свободном виде получил впервые в 1886 г. французский химик Анри Муассан, который
- 14. Хлор открыт шведским химиком К. Шееле в 1774 г. Элемент получил название за свой цвет (греч.
- 15. Бром открыт в 1826 г. французским химиком А.Баларом. Элемент назван так за свой запах (греч. бромос
- 17. Скачать презентацию













 Мастер -класс Божья коровка в технике канзаши Диск
Мастер -класс Божья коровка в технике канзаши Диск Правовое обеспечение местного самоуправления. Часть 2
Правовое обеспечение местного самоуправления. Часть 2 Презентация к логопедическому занятию в подготовительной группе по теме Ранняя весна.
Презентация к логопедическому занятию в подготовительной группе по теме Ранняя весна. a6e9bd53623e7a70f46310600f3
a6e9bd53623e7a70f46310600f3 Художественно – эстетическое развитие в МБДОУ, компенрсирующего вида №3 Ручеёк.
Художественно – эстетическое развитие в МБДОУ, компенрсирующего вида №3 Ручеёк. Основные модели развития науки и их критический анализ: кумулятивизм и антикумулятивизм, прогрессивизм и антипрогрессивизм
Основные модели развития науки и их критический анализ: кумулятивизм и антикумулятивизм, прогрессивизм и антипрогрессивизм Вирусные болезни схж - крс, мрс
Вирусные болезни схж - крс, мрс Организация предметно-пространственной среды для театрализованной деятельности
Организация предметно-пространственной среды для театрализованной деятельности Мини-проект Предприятия нашего города ОАО Невская косметика
Мини-проект Предприятия нашего города ОАО Невская косметика Switching systems
Switching systems Развитие артикуляционной моторики. Информация для родителей от учителя-логопеда.
Развитие артикуляционной моторики. Информация для родителей от учителя-логопеда. Работа с родителями в ДОУ (презентация)
Работа с родителями в ДОУ (презентация) GalaxyS7 Edge Repair Tips Troubleshooting Guide (by Part)
GalaxyS7 Edge Repair Tips Troubleshooting Guide (by Part) Классный час. Правила дорожного движения
Классный час. Правила дорожного движения Преемственность в обучении начальной школы и среднего звена
Преемственность в обучении начальной школы и среднего звена Биологическое оружие и его виды
Биологическое оружие и его виды Графика: прошлое и настоящее
Графика: прошлое и настоящее Жизненные цели подростка
Жизненные цели подростка Презентация к уроку с Марусей
Презентация к уроку с Марусей Методические рекомендации по оформлению научных работ
Методические рекомендации по оформлению научных работ Antihypertensive and lipid-lowering drugs
Antihypertensive and lipid-lowering drugs Природные комплексы Русской равнины. Презентация ученицы 8 класса МОУ Весеннинская ООШ Василевич Елены
Природные комплексы Русской равнины. Презентация ученицы 8 класса МОУ Весеннинская ООШ Василевич Елены Групповая работа. Команды по 4 ученика
Групповая работа. Команды по 4 ученика Урок хими 9 класс Реакции ионного обмена
Урок хими 9 класс Реакции ионного обмена Методы исследования в биологии
Методы исследования в биологии Консультация для педагогов Влияние музыки на психику человека
Консультация для педагогов Влияние музыки на психику человека Технология подключения, настройки и проверки работоспособности печатающих устройств
Технология подключения, настройки и проверки работоспособности печатающих устройств Инновационные технологии производства рыбных товаров
Инновационные технологии производства рыбных товаров