Содержание
- 2. P + 15 2, 8, 5 Возможные степени окисления: -3 PH3, Na3P +5 P2O5, H3PO4
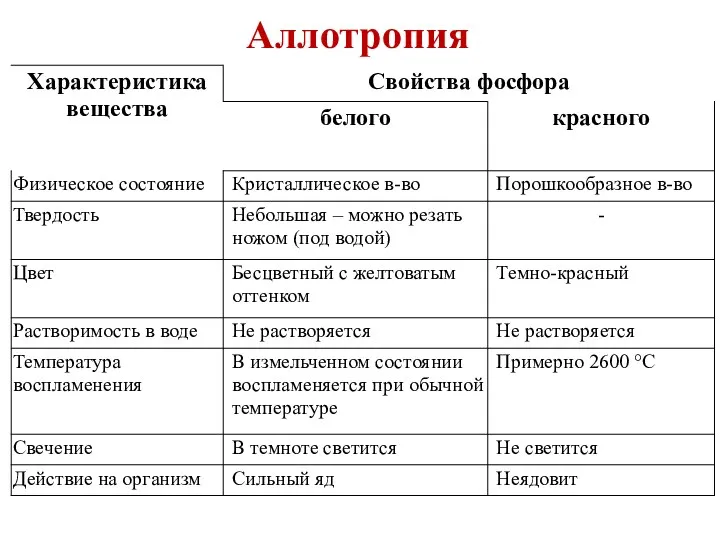
- 3. Аллотропия
- 4. Химические свойства С металлами 3Сa + 2P = Ca3P2 фосфид кальция Сa3P2 + 6HCl = CaCl2
- 5. Соединения фосфора P2O5 оксид фосфора (V) кислотный оксид P2O5 +3H2O = 2H3PO4 ортофосфорная кислота P2O5 +
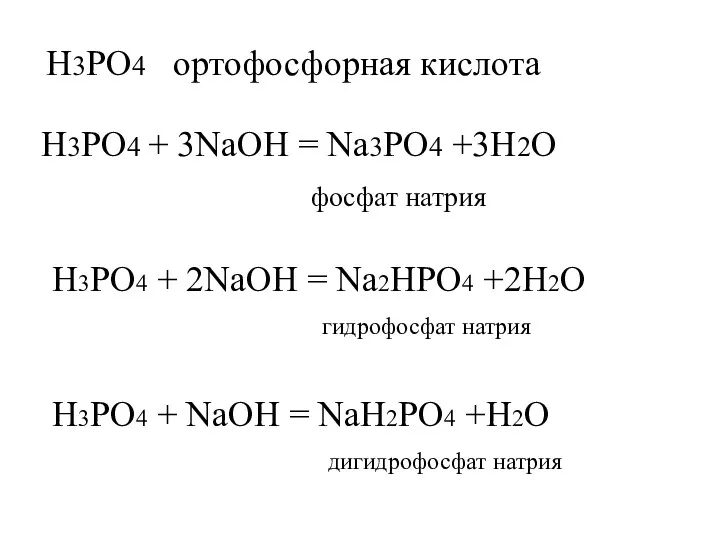
- 6. H3PO4 ортофосфорная кислота H3PO4 + 3NaOH = Na3PO4 +3H2O фосфат натрия H3PO4 + 2NaOH = Na2HPO4
- 10. Ca3(PO4)2 + SiO2+C = CaSiO3 + P + CO Какую массу фосфора можно получить из 290,6
- 11. Домашнее задание: п. 28, упр.3
- 13. Скачать презентацию







 Роботы будущего
Роботы будущего Бізнес-модель по реалізації хліба
Бізнес-модель по реалізації хліба Информационные жанры. Как писать заметку
Информационные жанры. Как писать заметку ВЫСТУПЛЕНИЕ 10.03.2015 Предпосылки успешного обучения ребенка в школе 1 часть
ВЫСТУПЛЕНИЕ 10.03.2015 Предпосылки успешного обучения ребенка в школе 1 часть Ассоциация деловых женщин Узбекистана Тадбиркор Аёл
Ассоциация деловых женщин Узбекистана Тадбиркор Аёл Анализ геометрических фигур
Анализ геометрических фигур Викторина Железноводск - жемчужина Кавказа
Викторина Железноводск - жемчужина Кавказа Общие вопросы по процессу обучения в аспирантуре
Общие вопросы по процессу обучения в аспирантуре Медицинская реабилитация при сколиозе
Медицинская реабилитация при сколиозе Презентация Мое село в годы войны
Презентация Мое село в годы войны Первые два года жизни: эмоциональное и социальное развитие
Первые два года жизни: эмоциональное и социальное развитие кл_Украина
кл_Украина Презентация. Здоровьесбережение. Здоровье учителя.
Презентация. Здоровьесбережение. Здоровье учителя. материалы к урокам 1 класс УМК Школа 2100
материалы к урокам 1 класс УМК Школа 2100 Деятельность психолога в чрезвычайных ситуациях
Деятельность психолога в чрезвычайных ситуациях Александр Сергеевич Пушкин и Тверской край
Александр Сергеевич Пушкин и Тверской край Учнівське самоврядування. Вибори
Учнівське самоврядування. Вибори Методический семинар
Методический семинар Кр по МОб Тех
Кр по МОб Тех Модель этиопатогенеза психических заболеваний. Критическая роль генетических факторов
Модель этиопатогенеза психических заболеваний. Критическая роль генетических факторов Основы классического наращивания + 2D volume
Основы классического наращивания + 2D volume Постмодернізм._2_
Постмодернізм._2_ Будем говорить правильно. Логопедический семинар – практикум для родителей
Будем говорить правильно. Логопедический семинар – практикум для родителей Слово в лексической системе русского языка. Лексическое значение слова. Смысловые отношения
Слово в лексической системе русского языка. Лексическое значение слова. Смысловые отношения Восстание под предводительством Е.И. Пугачёва
Восстание под предводительством Е.И. Пугачёва Бухгалтерский учет и анализ расчетов с покупателями и заказчиками АО Тандер
Бухгалтерский учет и анализ расчетов с покупателями и заказчиками АО Тандер Основы химии глин и глинопорошков
Основы химии глин и глинопорошков Социальная и правовая защита участников Оперативно-розыскной деятельности
Социальная и правовая защита участников Оперативно-розыскной деятельности