Содержание
- 2. АЗОТ
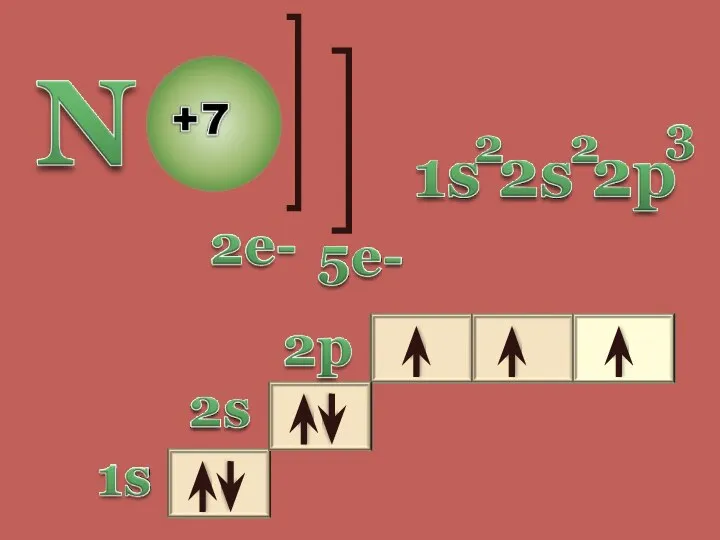
- 3. Строение атома азота Физические свойства Химические свойства
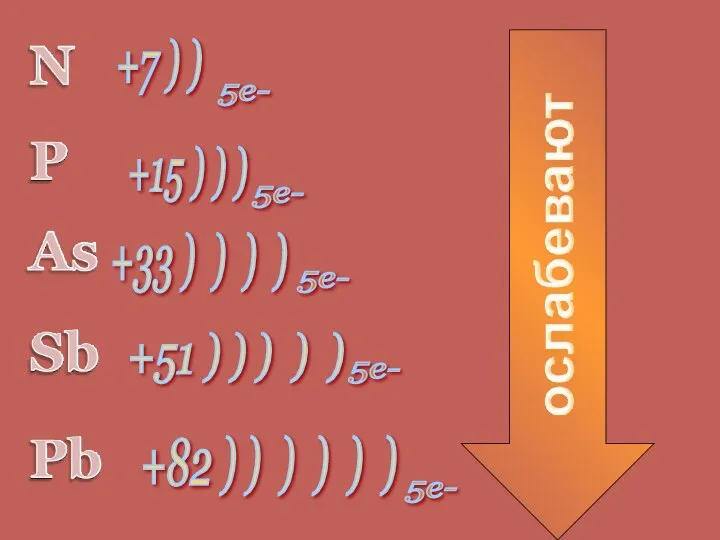
- 4. +7 ) ) +82 ) ) ) ) ) ) +51 ) ) ) ) )
- 7. N2 молекулярная формула N N электронная формула структурная формула
- 8. азот - простое вещество N2 Ткип = - 195 С Тпл = - 210 С 0
- 9. аммиак
- 11. получение в лаборатории в промышленности NH4NO2 → N2 + 2H2О Выделение из сжиженного воздуха
- 12. Получение Еще один лабораторный способ получения азота – разложение бихромата аммония: (NH4)2Cr2O7 →(t) Cr2O3 + N2↑
- 13. N2 Жидкий азот в медицине Синтез аммиака Производство удобрений Синтез азотной кислоты Создание инертной среды
- 14. Тест А1. Сумма протонов, нейтронов, электронов в атоме 14N 1) 7 2) 14 3) 28 4)
- 15. А3. Химическая связь в молекуле азота 1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
- 16. А5. Сумма коэффициентов в уравнении реакции между азотом и водородом равна 1) 2 2) 3 4)
- 17. А7. Азот является восстановителем в реакции 1) N2 + 3H2 = 2NH3 2) N2 + O2
- 19. NH3 + HNO3 = NH4NO3
- 20. Привести уравнения реакций взаимодействия концентрированной и разбавленной азотной кислоты с магнием и медью. Расставить коэффициенты методом
- 23. Скачать презентацию















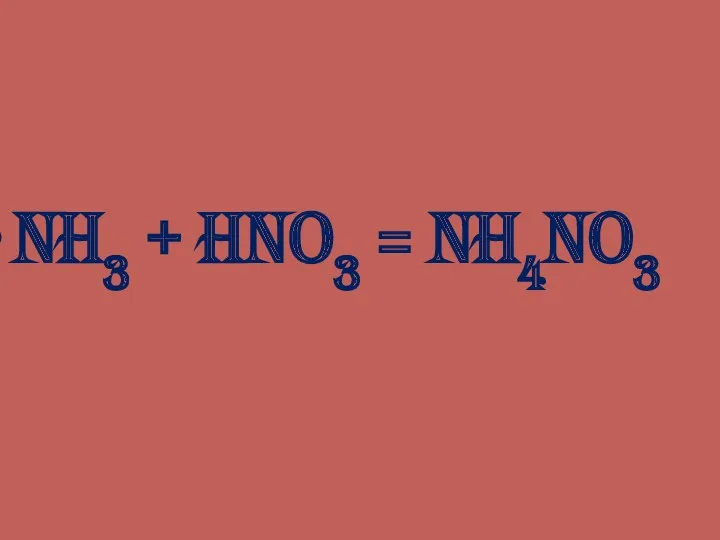

 Михаил Шолохов (1905-1984). Повесть Судьба человека
Михаил Шолохов (1905-1984). Повесть Судьба человека Михаил Матвеевич Стасюлевич (1826 – 1911)
Михаил Матвеевич Стасюлевич (1826 – 1911) Необычное путешествие
Необычное путешествие Зрительные диктанты часть 3.
Зрительные диктанты часть 3. Паренхиматозные дистрофии
Паренхиматозные дистрофии Особенности развития детей 3-5 лет
Особенности развития детей 3-5 лет Отчет о работе актива в Совете Старшеклассников
Отчет о работе актива в Совете Старшеклассников Презентация к игре Знаешь ли ты свой город?
Презентация к игре Знаешь ли ты свой город? формирование ключевых компетенций
формирование ключевых компетенций презентация Литераторы Кубани 19 век
презентация Литераторы Кубани 19 век Классный час Сигналы светофора
Классный час Сигналы светофора Постоянный ток
Постоянный ток 20230923_protsesy_mnogokletochnyh
20230923_protsesy_mnogokletochnyh Классификация инноваций
Классификация инноваций Этнометодология, как наука
Этнометодология, как наука Безопасный интернет
Безопасный интернет Робототехника. Повороты робота на месте. Независимое управление моторами
Робототехника. Повороты робота на месте. Независимое управление моторами Методы восстановления деталей
Методы восстановления деталей Великий русский художник Шишкин Иван Иванович
Великий русский художник Шишкин Иван Иванович Внешняя политика России в начале XX века. Русско-японская война
Внешняя политика России в начале XX века. Русско-японская война A Trip to London
A Trip to London Система охлаждения ДВС
Система охлаждения ДВС Без друзей меня чуть-чуть...
Без друзей меня чуть-чуть... Технічне обслуговування і ремонт кабельних ліній
Технічне обслуговування і ремонт кабельних ліній Настройка программного маршрутизатора полнофункциональной локальной сети малого предприятия
Настройка программного маршрутизатора полнофункциональной локальной сети малого предприятия Современные способы металлообработки
Современные способы металлообработки Адаптация детей к условиям детского сада посредством метода песочной терапии
Адаптация детей к условиям детского сада посредством метода песочной терапии Ислам. Мусульмане
Ислам. Мусульмане